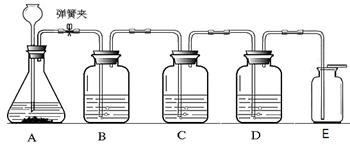
下列装置用于实验室中CO2的制备、净化、检验,最后收集一瓶干燥的CO2。请回答下列问题:
(1)对实验室制取二氧化碳药品选择的探究实验,记录如下:
| 组别 |
药品 |
实验现象 |
| ① |
碳酸钠粉末和稀盐酸 |
产生气泡速率很快 |
| ② |
块状石灰石和稀硫酸 |
产生气泡速率缓慢并逐渐停止 |
| ③ |
块状石灰石和稀盐酸 |
产生气泡速率适中 |
从制取和收集的角度分析,一般选择第 (填序号)组药品,所发生反应的化学方程式为 。
(2)C装置用于检验二氧化碳气体,则C中所盛放的物质是 ,发生反应的化学方程式是 。
(3)反应过程中将弹簧夹关闭,在A中观察到的现象是 。
(4)E收集方法说明二氧化碳具有的物理性质是 。
在学习实验室制取二氧化碳时,小莉同学查阅资料发现不能用浓盐酸做反应物制取二氧化碳 ,因为浓盐酸具有较强挥发性,会导致收集到的二氧化碳不纯(含有氯化氢气体);氯化氢气体溶于水就是盐酸(加热不易分解)。
【提出问题】氯化氢( HCl)气体显酸性吗?氯化氢气体的水溶液盐酸显酸性吗?
【进行实验】小莉同学根据二氧化碳与水反应的实验探究方法,用三朵紫色石蕊试剂染成的纸质干燥小花进行下图的三个实验:
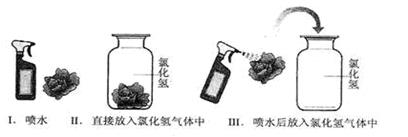
【实验现象和结论】
| |
实验Ⅰ |
实验Ⅱ |
实验Ⅲ |
| 现象 |
________________________ |
小花不变红 |
________________________ |
| 结论 |
水不显酸性 |
___________________ |
氯化氢溶于水形成盐酸显酸性 |
【实验反思】用石灰石和浓盐酸制取二氧化碳,将生成的气体通入紫色石蕊溶液中,溶液变成______色,原因是___________________________,短时间加热该红色溶液,溶液颜色变化情况是______________________。
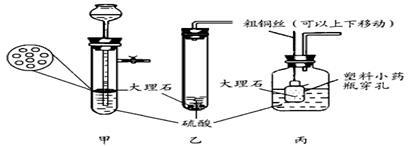
某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止。为此,该小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳。
【实验一】选择合适浓度的硫酸
操作:在28℃时,用装有5mL硫酸溶液的注射器向盛有1g直径为2mm大理石的大试管中注入硫酸,记录15分钟内生成气体的体积,见下表:
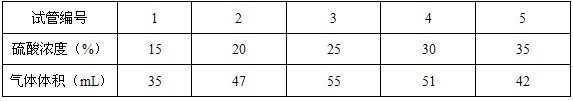
①稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为 %。
【实验二】选择合适的反应温度
操作:往盛有1g直径为2mm大理石的大试管中分别加入5mL相同合适浓度而不同温度的硫酸溶液,观察反应的情况,记录如下表:
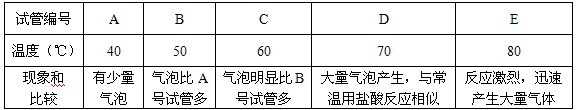
②在合适的硫酸浓度下,应选择最合适的反应温度为 ℃,在最合适反应温度时硫酸与大理石反应的化学方程式为 。
③除选用适当的温度和合适浓度的硫酸之外,在反应过程中,为防止硫酸钙覆盖在大理石上,应增加 操作,更有利于气体的制备。
④该研究小组为了研究 对该反应速率的影响,进行了如下实验。
| 试管编号 |
A |
B |
| 试管内药品 |
1g块状大理石与5mL25%稀硫酸 |
1g粉末状大理石与5mL25%稀硫酸 |
| 现象和比较 |
有少量气泡 |
迅速产生较多气泡 |
根据上述实验研究,在以下硫酸和大理石反应的装置中,最佳选用 (填编号)。