探秘海滩上的物质
在海滩上,你能见到各种各样的物质,除海洋生物外,最常见的有海沙、贝壳和海水。虽然它们性质和用途各异,但是元素组成的角度看,这些物质仅是由氧、碳、氢、率、钙等有限的几种元素组成的。
原子是构成物质的"基石"。一种粒子,可以构成最简单的单质,但更多的是跟其它原子结合成各种化合物,请回答:
(1)从化学的视角认识物质
①海沙是由石英和贝壳小碎片组成,石英的主要成分是(用化学符号表示,下同),贝壳的主要成分是。
②请写出一种同时符合下列两个条件的化合物的名称和化学式。
(Ⅰ)由氧、硅、氢、碳、钙五种元素中的三种组成;
(Ⅱ)按组成分类,与①中两种物质的主要成分类型不同。

③海水中含有多种无机盐,各离子的含量如图所示,其中由硫酸根离子和镁离子构成盐的化学式是。假设海水中无机盐的含量为3.5%。钾离子全部以氯化钾的形式存在,则Wg海水中含有氯化钾质量的计算公式为。
④各地海水中盐的含量并不完全相同,在长江入海口处,海水中盐的含量较低,原因是。
⑤食用低钠盐可预防高血压,低钠盐是在氯化钠中添加了适量的氯化钾,氯化钾除了有咸味外,还带有苦味,从物质构成的角度看,氯化钾有苦味可能是造成的。
(2)用化学的方法改造物质
海水中含有丰富的镁元素,目前工业上绝大多数金属镁是从海水中提取的,其生产流程如下:

①步骤一中发生反应的化学方程式为,。
②上述生产流程中发生的反应,没有涉及到的基本反应类型是。
③在步骤一中,分离出沉淀A的方法是。
除去
中混有的细砂,并利用得到的部分
配制溶液,实验过程如图所示:

(1)步骤Ⅱ的操作名称是;
(2)蒸发时,所用的仪器有铁架台(带铁圈)、、蒸发皿和玻璃棒;
(3)配制
质量分数为6%的
溶液,需
;
(4)下列情况对所配制溶液质量分数无影响的是
A.得到的
未完全干燥
B.用量筒量取水时,仰视读数
C.配好的溶液装瓶后,烧杯内有溶液残留.
要除去NaCl样品中少量的Na2SO4和CuCl2杂质,请根据所提供的试剂:NaOH溶液、稀HCl、BaCl2溶液分析并完成下列有关问题:(1)第一步:取NaCl样品溶于水,加入过量的 试剂,完全反应后,过滤,除去CuCl2杂质;所发生的化学反应方程式是 ;
(2)第二步:在第一步所得滤液中加入适量的 试剂,完全反应后,再过滤,除去样品中 的杂质;
(3)第三步:在第二步所得滤液中加足量的 ,完全反应后,再进行
操作,最后得到NaCl固体.
老师用如图所示装置为同学们做如下实验:A装置集气瓶中装有体积比约为1∶1的
氮气和气体a的混合气体,注射器中装有足量的无色溶液b;B装置中盛有少量紫色石蕊溶液;C装置中盛有适量生锈的铁钉;D装置中盛有足量的稀硫酸。、
(1)关闭活塞K1、K2,将注射器中的溶液b挤入瓶中,打开活塞K1,看到B中溶液进入A中后溶液变为蓝色,B中长导管脱离液面。请回答:
①若a气体是二氧化碳,则b是 溶液(填化学式)。
②若b是水,则气体a可能是 (填化学式)。
(2)保持K1开启状态,并打开K2,一段时间后关闭K2,整个过程中,观察到D中的现象是 (填编号,共2分);
A.广口瓶内液面下降 B.长颈漏斗内液面上升 C.长颈漏斗下端有气泡
写出C装置中反应的化学方程式是 。
为了制取
并验证它的性质,张林同学设计并进行了下图所示的实验,请根据要求回答有关问题。

(1)仪器
的名称是。
(2)
中玻璃管内发生化学反应的方程式为,酒精灯加上网罩的作用是。
(3)
中石蕊溶液始终没有变红,则
装置中
最有可能是(填序号)。
| A. |
稀硫酸 |
B. |
澄清石灰水 |
C. |
氢氧化钠溶液 |
(4)尾气的处理方法可以是。为了证明
中反应后的溶液里含有
,张林同学向溶液中滴加少许
溶液,结果没有观察到白色沉淀,你推测是(填物质的名称)的干扰。
宁波有较长的海岸线,每年能生产大量的食用盐。从海水中结晶的食盐一般混有
、
、
等杂质,为了除去上述杂质,设计了如下实验方案:先将固体溶解,然后向溶液中依次加人过量的
、
、
溶液,充分反应后过滤,将滤液蒸发结晶,得到较纯净的食盐。
(1)溶解、过滤和蒸发操作中都要用到玻璃棒。过滤时,玻璃棒的作用是。
(2)加入
溶液的目的是为了除去杂质。
(3)以上方案不够完善.应在过滤后增加一个步骤:往滤液中加入适量的。
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的
、
、
M等,工艺流程

根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是
、
和
,相对分子质量是89,针铁矿中铁原子数︰氧原子数︰氢原子数=。
(3)请写出氢氧化锌和稀硫酸反应的化学方程式。该反应的基本类型是.
(4)"滤液3"之前加入锌粉的目的是.
(5)"滤液3"之后的操作依次为、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于×100%。
有一包白色粉末可能由
、
、
、
、中的一种或多种物质组成。小明为了探究其成分,设计并完成了如下图所示的实验。

根据以上实验,回答:
操作①是
原固体粉末中一定没有的成分是
生成沉淀A的化学方程式是
根据上述实验(填'能'或'不能')确定原固体粉末中含有 、 。
根据下列数型图像回答:

(1)图一是用盐酸和氢氧化钠进行中和反应时,反应过程中溶液的pH变化曲线。向盐酸中加入的氢氧化钠溶液质量为mg时,所得溶液中含有的离子为(填离子符号)
(2)图二是20℃时,取10mL10%的NaOH溶液于烧杯中,逐滴加入10%的盐酸,随着盐酸的加入,烧杯中溶液温度与加入盐酸体积的变化关系
①由图可知中和反应是放热反应,你的依据为②甲同学用氢氧化钠固体与稀盐酸反应也能得到相同结论,乙同学认为不严密,因为
(3)图三是a、d、c三种物质的溶解度曲线。a与c的溶解度相交于P点,据图回答:
①t1℃时,接近饱和的c物质溶液,在不改变溶液质量的条件下,可用的方法达到饱和状态
②将t2℃时,150g a物质的饱和溶液降温到t1℃时。可以析出g a物质。
(4)下图托盘天平两边是等质量的铁和镁分别跟等质量等浓度的稀硫酸反应,反应时间t与生成氢气质量m的变化关系如图四。

试回答:从开始反应到不再产生气体为止,天平指针偏转情况是
某化学兴趣小组用一氧化碳与氧化铁的反应来探究炼铁的原理,装置如下图所示,请回答有关问题:


实验进行一段时间之后,A玻璃管内观察到的现象是
B装置中氢氧化钠溶液的作用是。
为避免将
排放到空气中,并回收利用
,方框中连接的是C和D装置,导管接口的连接顺序应为a→除
外,还有氢气等物质可以还原
,某同学设计了用金属锌粒与稀硫酸反应制取氢气的实验装置,如右图所示:
①制取氢气的反应方程式为②用E和F装置制取二氧化碳,F装置与E装置比较,优点是
南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的
溶液;b.加稍过量的盐酸;c.加过量的
溶液;d.过滤;e.蒸发。正确的操作顺序是(填字母)。加
溶液的作用是除去。
(2)海水淡化。下图是一个简易的蒸馏法淡化海水的装置。证明得到的水是淡水的方法是。

(3)海水制镁。从海水中提取金属镁的过程如下图所示:

在上述转化过程中发生中和反应的是 (填反应顺序号)。海水中本身就含有氯化镁,则①、②两步的作用是 。
(4)海水"制碱"。氨碱法制纯碱是先通过化学反应生成
和
,
结晶析出,再加热
制得纯碱。
①氨碱法制纯碱中生成
和
的化学方程式为 ;
②反应中生成
和
的质量比为84∶53.5,
和
的溶解度曲线如图所示。请分析
结晶析出而
没有结晶析出的原因是 。

燃煤产生的烟气中含有二氧化硫,直接排放会污染空气,它与水反应形成酸雨污染环境,某科研小组利用海水除去二氧化硫,其工艺流程见下图:

请回答下列问题:
(1)二氧化硫中硫的化合价是。
(2)用熟石灰中和稀硫酸的化学方程式是。
(3)亚硫酸(
)被空气中氧气氧化为硫酸,写出反应的化学方程式。
(4)为了研究脱硫率(脱硫率是已除去的二氧化硫的量占总二氧化硫量的百分比--与温度、烟气中
浓度的关系,他们进行了探究实验。实验结果如下:
| 实验序号 |
温度/℃ |
烟气中 浓度/ | 脱硫率/% |
| I |
23 |
2.5% |
99.5 |
| II |
23 |
3.2% |
97.1 |
| III |
40 |
2.5% |
94.3 |
由表中实验数据可得出的结论是。
(5)目前,科学家正在研究在一定条件下将乙烯(
)和烟气混合除去二氧化硫,其反应的过程可分为如下三步:
第一步:
与
反应生成
第二步: 与 反应生成
第三步:
与
反应生成
和
。
①反应中
的作用是。
②除去二氧化硫的总反应的化学方程式是。
粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).某班同学在粗盐提纯实验中,为把少量可溶性杂质
,
一并除去,将教材中实验方案修改设计如下,请据此回答问题:

(1)实验操作A的名称是,该操作的目的是.
(2)写出步骤③中发生反应的主要化学方程式 ;步骤⑥的作用是.
(3)小刚同学认为该方案实际得到的氯化钠可能比粗盐中含有的氯化钠要多,请你为他找出理由:.
下图是A、B、C、D四种粒子的结构示意图,回答下列问题:

(1)A、B、C属于离子的是(填写离子符号)。
(2)若D表示某元素原子,则m=,该元素的原子在化学反应中容易(选填"得到"或"失去")电子。
(3)在A、C形成的化合物中,C元素的化合价为。
我市拥有丰富的海洋资源,开发利用这些宝贵的资源有力地促进了我市经济的发展。
(1)从海水中提取出的粗盐中除了
外,还含有泥沙等杂质。请完善下列实验室中除去泥沙等杂质的实验步骤,并回答相关问题:

其中操作1的名称是;在过滤操作中要用到的玻璃仪器有烧杯、玻璃棒 、(填仪器名称);在加热蒸发过程中,当蒸发皿中 时,停止加热。
(2)上述除去泥沙后的澄清滤液中,还含有
等阳离子。要想知道该滤液是硬水还是软水,可加入进行检验。
(3)海水提取出粗盐后的母液中,还含有较多的氯化镁,用氯化镁可制得金属镁。工业上从母液中提取氯化镁的过程如下:
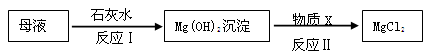
反应1的基本反应类型是;物质
是(填名称)。
(4)工业上可用电解饱和
溶液的方法制得烧碱、氯气和氢气,请写出该反应的化学方程式: ;
(5)从下列装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为(用接口处字母填写)。
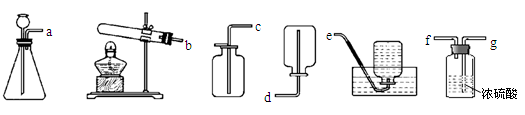
写出一个在实验室中用加热法制取氧气的化学方程式:。