如图,初中化学中,我们学习了酸和碱发生中和反应的实质是
。像这种实际参加反应的离子符号来表示反应的式子叫离子方程式.离子方程式的书写一般按以下步骤:(以
与
反应为例)

①写出反应的化学方程式:
②把易溶于水、易电解的物质写出离子形式,把难溶的物质、气体和水等仍用化学式表示.上述方程式可改写成:
③删去方程式两边不参加反应的离子:
④检查方程式两边各元素的原子个数和电荷总数是否相等.
请回答:
(1)下列各组中的离子,能在溶液中大量共存的是()
| A. | B. | ||
| C. | D. |
(2)写出稀盐酸滴在石灰石上所发生反应的离子方程式。
(3)写出一个与离子方程式
相对应的化学方程式。
(4)酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离子的反应,只要具备生成物中有气体或沉淀或生成,反应就能发生。
海水淡化可采用膜分离技术.如图一所示,对淡化膜右侧的海水加压,在其左侧得到淡水.其原理是海水中的水分子可以透过淡化膜,而其他各种离子不能透过。
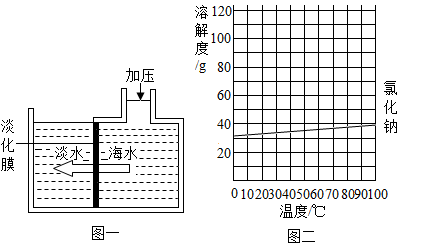
请回答:
(1)采用膜分离技术淡化海水的原理,与化学实验中常见的操作相似。
(2)对淡化膜右侧的海水加压后,海水中溶质的质量分数会(填"增大"、"减小"或"不变")。
(3)海水中含有大量的氯化钠,图二是氯化钠的溶解度曲线,据此可知盐场从海水中得到食盐晶体利用的方法是结晶(填"降温"或"蒸发")。
碳单质有金刚石、石墨和足球烯(
)等,碳的化合物更是种类繁多。
(1)金刚石由 构成(选填"分子"、"原子"或"离子"),足球烯(
)在氧气中完全燃烧,生成物是.
(2)小苏打片( )可治疗胃酸(主要成分是盐酸)过多,写出反应的化学方程式.
(3)烯烃是一类重要的有机化合物,它由碳、氢两种元素组成,烯烃分子中碳、氢原子数目有一定关系,其关系式可用 表示( ), 表示碳原子个数,当 时是乙烯( ),当 时,其化学式为.
酸、碱、盐在生活、生产中应用广泛,使用时必须十分小心,氢氧化钠具有强烈的,实验时最好戴防护眼镜,为了便于理解和记忆,小丽同学总结了碱的化学性质如图,请你根据要求完成下列问题:

(1)小丽同学发现,以前取用氢氧化钠溶液时试剂瓶忘记盖瓶塞,依据反应③说明
必须密封保存,否则在空气中要变质,如果该溶液变质,则发生反应的化学方程式为;
(2)要检验该氢氧化钠溶液已变质,选择下列试剂不能达到目的是
| A. |
稀 |
B. |
酚酞试液 |
C. |
|
D. |
|
(3)为了验证反应④,小丽将无色酚酞试液分别滴入
溶液和澄清石灰水中,溶液由无色变成红色,原因是它们在水溶液中能电离出。
(4)依据反应②,
能与下列物质反应的是.
| A. |
|
B. |
|
C. |
|
D. |
|
发生反应的化学方程式为:.
(5)硫酸铵[ ]、磷酸二氢钙[ ]、亚硝酸钠( )、硝酸钾( )等属于盐,其中又属于复合肥的。
(1)铝是地壳中含量最多的金属元素,在元素周期表中铝元素的信息如图所示:

①铝的原子结构示意图为;
②铝离子的核外电子数为;
③工业上用电解熔融的方法冶炼铝,化学方程式为:
,该反应属于基本反应类型中的。
(2)要除去下列混合物中的杂质(括号内为杂质),写出除去杂质的化学方程式:
①
;
②
.
化学是在分子、原子层次上研究物质的性质、组成、结构与变化规律的科学.请你按要求填空.

在宏观、微观和符号之间建立联系是化学学科的重要思维方式。(1)根据下列粒子结构示意图,回答问题:

①上述示意图中,共包含种元素,它们之间的本质区别是不同。
②ABCE中属于阴离子的是(填离子符号)
③若D表示某元素的原子,则m=,该粒子在化学变化中容易(选填"得到"或"失去")电子。
④若D为离子,则BD组成的化合物的化学式为 。
(2)下图表示某反应的微观示意图,其中不同的球代表不同元素的原子,请画出X分子的微观示意图。

用如图实验方法分离
和
两种固体的混合物A,根据操作流程完成下列问题:
(1)B物质是.
(2)过滤操作中玻璃棒的作用是.
(3)经分析上述方法分离出的F含杂质,请对该设计方案加以完善.
(4)若用原操作方法,要测出混合物A中
和
的质量比,不称量D,可通过称量和的质量求解.
小明同学利用已使用过的生石灰干燥剂和敞口放置在空气中的烧碱固体进行了一系列实验,如下是他的实验记录:
①取干燥剂和烧碱固体同时放入水中,搅拌后过滤,得到白色固体甲和滤液乙。
②把白色固体甲分成两份,一份放入水中,搅拌后过滤,向滤液中滴加无色酚酞,滤液为无色;另一份加入溶液丙,产生气泡。
③向滤液乙中加入过量溶液丁,充分反应后过滤,得到白色固体甲和滤液,向滤液中滴加无色酚酞,滤液为无色。
④试根据以上的实验记录,回答下列问题:
(1)①步骤中的白色固体甲来源于
(2)滤液乙、溶液丙、溶液丁三种溶液的溶质所属的物质种类有 (填序号)
A.酸 B.碱 C.盐
(3)写出步骤③中发生的化学反应方程式:
(4)下列说法正确的是( )
A.生石灰干燥剂仍有干燥作用
B.生石灰干燥剂已完全失效
C.烧碱固体部分变质
D.烧碱固体完全变质
(1)等质量的
、
两种物质分别与等质量的同浓度的稀盐酸充分反应,反应产生气体的质量与反应时间的关系如甲图所示。请回答下列问题:
①若
、
为
中的一种,则
是,反应结束后只有一种金属剩余,则剩余金属为。
②若
、
为碳酸钠粉末和碳酸钙块状固体中的一种,反应结束后,则它们消耗的酸(填"
多"、"
多"或"相等")。
反应至
点时,所得溶液的溶质为(写化学式)。
(2)如图所示,
、
、
、
、
分别是铁、硝酸铜溶液、二氧化碳、稀硫酸溶液、氢氧化钠溶液中的一种,
是硝酸铜溶液。("-"相连两物质能发生反应)请回答:

①
的化学式为,
物质的一种用途:。
②
与
反应的化学方程式,基本反应类型是。
请你和同学们一起完成下列实验。
(1)用浓盐酸(溶质质量分数为37%,密度为1.18
)配制200
10%稀盐酸。
①配制的主要步骤为:计算、、溶解。
②设需浓盐酸的体积为
,请列出
的计算式(不必算出结果)。
③现提供下图仪器,仪器
的名称为;配制过程中还需要的仪器有。

(2)现提供下列装置:

①实验室制取二氧化碳,发生和收集装置应选用(填序号),发生反应的化学方程式为。实验结束,从反应残留物中提取固体溶质时,按如下流程操作:

②如选用另一发生装置制取某种气体,发生反应的化学方程式为。
过氧化钙晶体﹝
﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:

(1)气体
是
,其名称是;将过氧化钙晶体与溶液分离的方法是。
(2)反应
需控制温度在
,可将反应容器放在中,该反应是化合反应,反应产物是
,请写出化学方程式。获得的过氧化钙晶体中常含有
杂质,原因是。
(3)
的相对分子质量为,过氧化钙晶体﹝
﹞中
、
元素的质量比为。
(4)为测定制得的过氧化钙晶体中
的质量分数,设计的实验如下:称取晶体样品
,加热到
充分反应(方程式为
,杂质不发生变化),测得生成氧气的质量为
,请计算样品中
的质量分数(
相对分子质量为
),写出必要的计算过程。
根据下列坐标图回答:

(1)图一表示甲、乙、丙三种物质的溶解度曲线。
①
时,甲、乙的溶解度均为。
②将甲、乙、丙三种物质
时的饱和溶液升温到
,所得溶液中溶质的质量分数最大的是。
(2)某学习小组模拟海水,以测定海水中氯元素的质量分数。取模拟海水(含
、
)
,向溶液中滴加
的硝酸银溶液,其沉淀质量变化如上图二。
①沉淀的化学式为。
②模拟海水中氯的质量分数是。
据报道,全球每年浪费掉的粮食约有1000亿吨,其中,约300亿吨是加工过的食品。下图是一包烤花生的图片,图中的脱氧剂在食品防腐保鲜,特别是对延长含高油脂食品的保质期有着重要作用。请回答下列问题:

(1)花生中富含的营养素是(答出一种即可),检验这包脱氧剂中含有铁粉的方法是。
(2)脱氧剂的作用原理是脱氧剂中的铁粉与氧气、水发生反应生成氢氧化铁,写出该反应的化学方程式,据此判断脱氧剂对食品具有防腐保鲜作用的原因是(填序号)。
a.脱氧剂具有杀菌、消毒的作用
b.脱氧剂吸收水分,使食品保持干燥
c.脱氧剂吸收氧气,防止食品发生缓慢氧化
(3)钢铁是应用最广泛的金属材料,写出工业上炼铁原理的化学方程式;我们日常生活中使用的清洁球,就是用不锈钢丝制作的,这是利用了金属铁具有的;铝、铁、铜三种金属在历史上被人类使用的时间先后顺序是,你认为其原因可能是。
(4)据统计,我国每年因金属腐蚀造成的经济损失约占国民生产总值的2%~4%,防止金属腐蚀具有重要意义。答出一种防止金属腐蚀的措施。
连云港碱厂年产纯碱120万吨,是我国三大纯碱生产企业之一。它的产品除了纯碱外,还有氯化钙和碳酸氢钠。该厂生产纯碱的工艺流程可简单表示如下:

其生产过程中涉及的主要化学反应有:
①
↓
②
↑
请回答:
(1)①"碳化"过程中需要的
,可由石灰石高温煅烧得到,该反应的化学方程式为。
②实验室中,通常用稀盐酸与石灰石反应制取
气体,不选用浓盐酸的理由是;干燥
气体,可用的干燥剂是(填字母)。
| A. |
浓硫酸 |
B. |
固体氢氧化钠 |
C. |
生石灰 |
(2)①该厂"过滤"所得的
可作化肥中的肥,它也可与
在加热时发生反应生成产品
,同时还有
和
生成,写出该反应的化学方程式:。
该厂的另一种产品碳酸氢钠俗称,它的重要用途有(只写一种)。
②实验室进行"过滤"操作时,下列说法正确的有(填字母)
| A. |
使用的漏斗叫长颈漏斗 |
B. |
液面应低于滤纸边缘 |
C. |
玻璃棒应不停搅拌 |
D. |
漏斗下端的管口要紧靠烧杯内壁 |
(3)某化学兴趣小组的同学为了测定该厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计了如下两种实验方案:
方案一:称取样品10.65
,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤,干燥得固体19.70
。通过计算(写出计算过程)判断该厂的产品是否属于优等品。(杂质可溶于水且不与氯化钡反应)
方案二:用下图所示的装置,通过准确测量排出水的体积,也可计算样品的纯度。该装置中
仪器的名称是,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是。(装置的气密性良好)
