珍珠粉是由珍珠经加工制成的白色粉末,含有碳酸钙、蛋白质等成分,是重要的药品、化妆品原料.但市场上出现的假珍珠粉外观上与真珍珠粉差不多,肉眼往往无法辨别它们.
(1)为了寻找区分真假珍珠粉的方法,科学兴趣小组的同学进行了如图1实验:
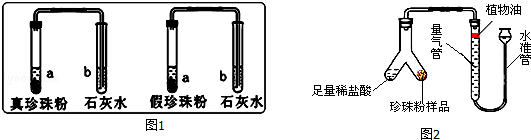
实验一:分别取真假珍珠粉适量置于两支试管中,加一定量的稀盐酸并将产生的气体通入澄清石灰水中,发现澄清石灰水均变浑浊,说明真假珍珠粉均含有 .
实验二:分别取真假珍珠粉稍许置于铁片上灼烧,发现真珍珠粉能闻到烧焦羽毛气味;假珍珠粉未闻到烧焦羽毛气味,由此可得出结论:假珍珠粉中不含 .
(2)为了比较真假珍珠粉中碳酸钙的含量,共进行了三次实验,每次各取5g真假珍珠粉,分别置于如图2实验装置中(稀盐酸足量且真假珍珠粉中只有碳酸钙与稀盐酸会反应生成气体),测定生成气体体积数据如下表:
| 样品气体体积mL次数 |
第一次 |
第二次 |
第三次 |
| 假珍珠粉 |
117.50 |
117.28 |
117.05 |
| 真珍珠粉 |
111.52 |
111.66 |
111.86 |
①量气管中水面上方加一层植物油的目的是 ,由实验数据可知:真珍珠粉中碳酸钙的含量 假珍珠粉(填“>”、“<”、“=”).
②根据三次测量结果,取平均值,算得5g真珍珠粉生成的气体质量为0.22g,求:真珍珠粉样品中CaCO3的质量分数.
如图是稀盐酸和氢氧化钠溶液,其中一种物质逐滴加入另一种物质过程中溶液酸碱度的变化情况.

(1)该实验操作是将 滴加到另一种溶液中.
(2)图中 点时溶液中酸和碱恰好完全反应.
(3)若要将36.5克10%的盐酸全部反应完,需要NaOH多少克?(HCl+NaOH═NaCl+H2O)
某些花岗岩石材中含有放射性氡。氡原子的质子数为86,中子数为136,这种氡原子核外电子数为
工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁元素的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
[资料1]碱石灰既能吸收水又能吸收二氧化碳;浓硫酸可以吸收水蒸气;
[资料2]实验室常用氢氧化钠溶液来除去CO2反应生成碳酸钠和水;用澄清的石灰水
来检验CO2气体;
[资料3]草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4·3H2O CO2↑+ CO↑+ 4H2O
CO2↑+ CO↑+ 4H2O
(1)下列可用作草酸分解制取气体的装置是 (填字母编号)。

【问题讨论】用下图所示装置进行实验:

A B C D E F
(2)实验前应先 。
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是 、 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)写出A装置中发生的化学反应方程式 。
(5)B装置的作用是 。
(6)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前 。 ②停止加热后 。
(7)写出D装置中所发生反应的一个化学方程式 。
【数据分析与计算】
[资料4]铁的常见氧化物中铁的质量分数:
| 铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
| 铁的质量分数 |
77.8% |
70.0% |
72.4% |
(8)称取铁红样品10.0 g,用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为m g,则 < m < 。
② 实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是 。
【实验评价】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会 (填“偏小”、“不变”或“偏大”)。
反思2:请指出【问题讨论】中实验装置的一个明显缺陷 。
环保石头纸的主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂。
【实验一】 探究影响石头纸与盐酸反应快慢的因素
(1)甲、乙两同学设计实验如下:
| |
甲 |
乙 |
| 实验过程 |
 |
 |
| 现象 |
试管①、②、③中产生气泡快慢的顺序为:①>②>③。 |
|
| 分析结论 |
Ⅰ 碳酸钙与稀盐酸反应的化学方程式为 ; Ⅱ 对比甲同学实验①②可知, ,化学反应的速度越快; Ⅲ 对比甲同学实验 (填实验序号)可知,反应物的接触面积越大,反应速率越 。 Ⅳ 乙同学的实验中,应该连续记录的实验数据是 和 。 |
【实验二】 测定石头纸中碳酸钙的质量分数 提示:石头纸中其他成分均不与盐酸反应,也不溶于水。
(2)甲组同学:图Ⅰ为石头纸与稀盐酸反应的装置,图Ⅱ用于测量通常状况下CO2的体积。

①实验前首先要 ;
② 图Ⅱ装置中油层的作用是 ;
③ 反应完成后,先 (填具体操作),然后才能准确读得量气管中的CO2的体积。
④根据V CO2和ρCO2计算出CO2的质量,计算碳酸钙质量。
(3)乙组同学:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表。
| |
第1份 |
第2份 |
第3份 |
第4份 |
| 取样品质量(g) |
6.25 |
6.25 |
6.25 |
6.25 |
| 取稀盐酸的体积(mL) |
10.0 |
20.0 |
30.0 |
40.0 |
| 产生气体的质量(g) |
0.88 |
1.76 |
2.20 |
m |
通过对数据的分析和比较,回答下列有关问题
①在第 份样品的实验中,样品中碳酸钙完全反应了; 。
② m的值为
③石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
新的一年,同学们的学习方式有了很大变化。下面是《气体制取与收集》学习的课堂片段:
【自主学习】仿照氧气制取的学习和气体制取的一般思路,阅读课本,老师提供了几组药品,让同学们交流并选出适宜实验室制取二氧化碳的一组。
【合作交流】围绕以上问题,各小组展开了激烈的交流,下面是老师从第二小组同学交流中听到的各位学生的发言:
1号:碳酸盐用块状石灰石(主要成分碳酸钙),为什么不用纯碱(碳酸钠)呢?
3号:碳酸钠是粉未状的,反应的速度太快,不易控制,
2号:同意3号同学的说法,那我们把碳酸钠压制成块状可以吗?
各位都在思考,问题未能解决。
【展示释疑】通过各个小组的展示,大家明白了实验室制取二氧化碳应该选择石灰石和稀盐酸。
实际实验中,所用的原料或产物一般都含有杂质,在计算用料和产量时,应考虑到杂质问题。
请你帮助二组学生解决2号学生提出的问题,实验室把碳酸钠压制成块状_______(选填“可以”或“不可以”)代替石灰石制取二氧化碳。
【能力提升】某小组想测定所用石灰石样品中碳酸钙的质量分数,取用了2g的石灰石样品,把20g稀盐酸(氯化氢的水溶液)分4次加入样品中,(样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶解于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
| 稀盐酸的用量 |
剩余固体的质量 |
| 第一次加入5g |
1.5g |
| 第二次加入5g |
1.0g |
| 第三次加入5g |
0.5g |
| 第四次加入5g |
0.3g |
(1)从以上数据可知,这四次实验中,第______次石灰石样品中碳酸钙已完全反应。
(2)求石灰石中碳酸钙的质量分数?
(3)求检测过程中所产生二氧化碳的质量?
下图是已破损的维生素C(简写Vc)说明书部分信息。已知Vc由碳、氢、氧三种元素组成。

(1)Vc中碳、氢元素质量之比为 ;
(2)Vc的化学式为 ;
(3)小明妈妈每天服用Vc片剂,小明建议妈妈可食用西红柿代替Vc片,若100g西红柿中含Vc30mg,则妈妈每天食用西红柿 g即可达到服用上述Vc片的效果。
一个碳12原子的质量为akg,若某原子的相对质量为M 则该原子的实际质量为多少?若该原子的核外有m个电子,则其核内有多少个中子?
为测定某氮肥中硫酸铵的纯度(及质量分数)是否与下图标签相符合,小林取一定量该氮肥样品于烧杯中配成溶液与足量氯化钡溶液反应,记录有关数据如下表:


【反应的化学方程式为(NH4)2SO4+BaCl2 =BaSO4↓+2NH4Cl,其他成分能溶于水但不参加反应】
(1)反应共生成BaSO4的质量为g。
(2)若所取氮肥样品的质量为15g,试通过计算确定该氮肥中硫酸铵的纯度是否与标签相符。(请写出计算过程)
(3)反应前后,溶液中硫元素的质量是(填"不变"、"增大"或"减小")。
某品牌可乐由水、白砂糖、焦糖色素(使可乐显黑褐色)、磷酸(H3PO4)等,按一定比例混合并压入二氧化碳配制而成。某同学为了探究可乐的成分及其含量,进行如下实验。
实验一 可乐中二氧化碳的定性检验
(1)请完成下表:
| 实验步骤 |
实验现象 |
结论 |
| 打开一塑料瓶装可乐,塞上带导管的橡胶塞,把导管插入(填化学式)溶液中 |
观察到 | 可乐中含有二氧化碳 |
实验二 可乐中磷酸的定量测定
测定过程如下:

(2)步骤①用活性炭浸泡的目的是。
(3)步骤③煮沸10分钟的目的是除尽滤液中的。
(4)已知步骤④反应的化学方程式为
,测得共消耗0.1%的NaOH溶液20g,忽略可乐中其它成分对测定结果的影响,计算可乐中磷酸的含量(以g/L为单位。相对分子质量:
-98;
-40),写出计算过程。
(5)如果步骤②缺少洗涤,则测定结果(填"偏高""不变"或"偏低")。
兴趣小组的同学探究一瓶敞口放置的NaOH溶液(原质量分数为10%)是否变质,进行了下述实验:
| 同学 |
小柯 |
小江 |
小龙 |
| 操作 |
各取一支相同规格的试管,在试管中加入一定量的待测溶液 |
||
| 滴入无色酚酞 |
加入足量的 ? |
加入足量的BaCl2溶液 |
|
| 现象 |
变红 |
产生气泡 |
产生白色沉淀 |
| 结论 |
没变质 |
变质 |
变质 |
(1)小江加入的"?"是。
(2)小江认为小柯的实验和结论不正确,理由是。
(3)小龙将沉淀过滤、洗涤、干燥,称量质量为1.97
。已知小龙所取的待测溶液质量为10
,请根据化学方程式计算,该待测溶液中变质生成物的质量分数。
四氯化硅(
)是一种 重要的化工原料,遇水会发生如下反应:
某地曾发生将含有四氯化硅的废料倒入池塘造成污染的事件,事后环保人员在受污染的池塘中投放熟石灰〔
〕作了有效处理。
(1)已经
不跟
反应,为了确定投入熟石灰的质量,要先测定废料倒入池塘后生成盐酸的质量。选用下列哪组数据能确定池塘中生成
的质量
A.倒入废料的总质量、废料中
的质量分数
B.池塘水的
C.池塘水中
的质量分数
(2)经测定池塘水中共有0.365吨盐酸,则需要加入多少吨熟石灰才能将其完全反应。
(列式计算,相对原子质量:
:1
:16
:35.5
:40)
(7分)某校化学兴趣小组的同学开展了测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验。他们设计了如下的实验方案:
(1)“操作1”的名称是___________,溶液M中的溶质 (写化学式)。
(2)滴加CaCl2溶液应“过量”,否则可能会使测定的结果 (填“偏大”或“偏小”),确定CaCl2溶液是否过量的方法是 。
(3)该混合物中Na2CO3的质量分数是多少?(写出解题过程,计算结果精确到0.1%)