4g氧化镁与100g稀盐酸恰好完全反应,计算该稀盐酸中溶质的质量分数(结果精确到0.1%).(反应的化学方程式为MgO+2HCl═MgCl2+H2O).
24g某氯化钡样品中含有少量的氯化钠,某同学进行了如图所示的实验。请计算:

(1)生成沉淀的质量;
(2)D烧杯中所得溶液的溶质质量分数。
现有硫酸钠和氯化钠的固体混合物30g,加316.6g水使之全部溶解,将300g氯化钡溶液分三次加入该溶液中,实验数据记录如表:
第1次 |
第2次 |
第3次 |
|
加入氯化钡溶液质量/g |
100 |
100 |
100 |
生成沉淀的质量/g |
23.3 |
m |
46.6 |
(1)表中m的数值是 。
(2)原固体混合物中硫酸钠的质量分数是多少?(计算结 果精确到0.1%)
(3)恰好完全反应时,所得溶液中溶质的质量分数为多少?
为了测定石灰石中碳酸钙的质量分数,现取12.5g石灰石(杂质不反应也不溶解)加入盛有105.4g稀盐酸的烧杯中,反应中烧杯内物质的质量与反应时间的关系如图所示,请计算:
(1)完全反应时生成二氧化碳多少克?
(2)石灰石中碳酸钙的质量分数是多少?
(3)完全反应时,所得溶液中溶质的质量分数是多少?

实验室用锌粒与足量稀硫酸反应,制取氢气并还原4.0g氧化铜,实验装置如图(装置气密性良好,夹持仪器省略).
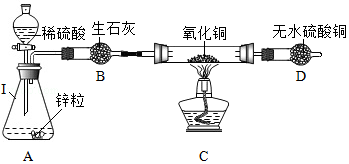
①仪器Ⅰ的名称 ,A中反应的化学方程式是 .
②B中生石灰作 剂;C中反应的化学方程式是 ;D中现象是 .有关的化学方程式是 .
③为确定实验结束后氧化铜是否已基本消耗完,请设计两种不同的方案填入下表.
操作 |
判断依据 |
结论 |
|
方案一 |
|
|
|
方案二 |
|
|
|
化学兴趣小组为测定某铜锌合金中成分金属的含量,称取10g样品放入烧杯中,向其中加入100g稀硫酸,恰好完全反应后。测得烧杯内所有物质的总质量为109.8g。
请完成下列分析及计算:
(1)反应中共生成气体 g。
(2)计算合金中铜的质量分数。
某补钙剂的主要成分是碳酸钙。欲测定该补钙剂中碳酸钙的质量分数,某同学进行了如图所示的操作(假设其它成分可溶于水但不参与反应)。

(1)该实验中,装置的气密性对测定结果 (填“有”或“无”)影响。
(2)计算该补钙剂中碳酸钙的质量分数。
为测定一瓶未知浓度的硫酸的溶质质量分数,化学兴趣小组向含有酚酞的100g 4%的氢氧化钠溶液中滴加该硫酸,恰好完全反应时溶液总质量为150g。(酚酞质量不计)
(1)恰好完全反应时的现象是 。
(2)计算硫酸的溶质质量分数。
化学兴趣小组按如图实验测定部分变质的NaOH固体中Na2CO3的质量分数
(1)根据题中信息 (填“能”或“不能”)计算Ca(OH)2溶液的溶质质量分数
(2)计算固体混合物中Na2CO3的质量分数。
某学校组织社会调查,同学们考察了一家化工企业的污水处理情况。企业技术人员用氢氧化钙粉末对中和池内的296kg污水进行中和处理(污水中的主要污染物是盐酸),测定处理后水样的pH等于7,请回答:
(1)技术人员称量9.0g氢氧化钙粉末,示意图如图所示。请你写出所选砝码的质量 和游码的示数 。
(2)假设上述氢氧化钙与中和池内污水中的盐酸恰好完全反应(污水中的其他成分均不与氢氧化钙反应),计算污水中HCl的质量分数是多少?(写出计算过程)
一化工厂产生的废液中含有硫酸亚铁和硫酸铜(不考虑其它物质),为回收铜和硫酸亚铁,研究人员设计出“用铁处理”的方案,取100g上述废液,向其中加入2.8g铁粉,恰好完全反应,测得反应后溶液中溶质的质量分数为15%,求:
(1)回收得到铜的质量为 g
(2)回收得到硫酸亚铁的质量是多少?(写出计算过程)
某环保小组监测到一造纸厂排放的废水中含有碳酸钠和硫酸钠两种物质,为测定废水中这两种物质的含量,环保小组的同学进行了以下实验:取该造纸厂排放的废水200g,先向其中加BaCl2溶液至ng后停止,然后再滴加稀盐酸,反应过程中加入溶液的质量与产生沉淀和气体的质量关系如图所示.
(假设废水中其它成分不参与反应;钡的相对原子质量为137)
请根据图象与数据分析计算:
(1)a、b、c三点对应的溶液中所含BaCl2的质量关系是 (用“>”、“<”或“=”表示).
(2)m值等于 .
(3)该废水中硫酸钠的溶质质量分数(写出计算过程).

实验室有一份部分被氧化成氧化镁的镁粉样品,未知浓度盐酸和40%的氢氧化钠溶液,兴趣小组同学为分析样品中金属镁的质量分数含量和计算盐酸的质量分数,进行如下探究:
(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量,实验数据如表所示:
实验序号 |
所取样品质量(g) |
所加盐酸质量(g) |
生成氢气质量(g) |
Ⅰ |
16.0 |
60.0 |
0.5 |
Ⅱ |
16.0 |
130.0 |
1.0 |
Ⅲ |
16.0 |
150.0 |
1.0 |
镁粉样品中金属镁的质量百分含量为 。
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示。计算盐酸的质量分数。(写出计算过程)

测定抗酸药物有救成分的含量胃酸的主要成分为盐酸,胃酸太多导致胃不舒服时,可以考虑服用抗酸药物来中和胃酸.某抗酸药物的有效成分为氢氧化镁,为测定氢氧化镁的含量,小霞同学取一片该药物(规格为lg)于烧杯中,加入20g溶质质量分数为3.65%的稀盐酸,恰好完全反应(假设药物中其他成分可溶于水,但不与盐酸反应).
(1)通过已知数据能求出的量有 (填字母编号,符合题意的选项都选).
A.每片药物中氢氧化镁的含量 B.反应中生成氯化镁的质量
C.反应后溶液中氯化镁的质量分数 D.20g稀盐酸中水的质量
(2)计算1g该药物中含氢氧化镁的质量(要求写出计算过程).