铜、铁是人类使用最早、应用广泛的金属.
(一)对古代制品的认识
青铜铸件、丝绸织品、陶瓷器皿是我国古代劳动人民创造的辉煌成就.
1、上述制品不涉及到的材料是 (选填序号).
A、金属材料 B、无机非金属材料 C、复合材料
2、如图1为出土文物古代青铜铸件"马踏飞燕".该文物能保存至今的原因可能是 (选填序号).
A、铜的活泼性弱 B、铜不会生锈 C、深埋于地下,隔绝空气
(二)铁、铜的冶炼
1、我国古代曾用孔雀石炼铜,涉及主要反应的化学方程式: ,2CuO+C  2Cu+CO 2↑.
2Cu+CO 2↑.
2、铁、铜矿石有赤铁矿(Fe 2O 3)、磁铁矿(Fe 3O 4)、黄铁矿(FeS 2)、黄铜矿(CuFeS 2)等.CuFeS 2为二硫化亚铁铜,其中S元素的化合价为 .
(1)工业炼铁大多采用赤铁矿、磁铁矿.以磁铁矿为原料炼铁反应的化学方程式为 .炼铁不采用黄铁矿、黄铜矿,可能的原因是:
①黄铁矿、黄铜矿含铁量相对低;② .
(2)以黄铜矿为原料,采用生物炼铜是现代炼铜的新工艺,原理为:4CuFeS 2+17O 2+2H 2SO 4  4CuSO 4+2Fe 2(SO 4) 3+2H 2O.
4CuSO 4+2Fe 2(SO 4) 3+2H 2O.
向上述反应后的溶液中加入Fe粉,得到FeSO 4溶液和Cu.
①发生主要反应的化学方程式:Fe+Fe 2(SO 4) 3=3FeSO 4, .
②FeSO 4溶液经蒸发浓缩、 、过滤等操作得到FeSO 4•7H 2O晶体.
(三)黄铜矿中铁、铜含量的测定
在科研人员指导下,兴趣小组称取25.00g黄铜矿(含少量Fe 2O 3和其它不含金属元素的杂质)模拟生物炼铜,使其全部转化为CuSO 4、Fe 2(SO 4) 3溶液.向溶液中加入过量NaOH溶液得到Cu(OH) 2、Fe(OH) 3固体.
1、证明NaOH溶液过量的方法:静置,向上层清液中滴加 溶液,无现象.
2、用图2装置对固体进行热分解实验.
【资料】
①在68℃时,Cu(OH) 2分解为CuO;在500℃时,Fe(OH) 3分解为Fe 2O 3.
②在1400℃时,CuO分解为Cu 2O和O 2,Fe 2O 3分解为复杂的铁的氧化物和O 2.
(1)装配好实验装置后,先要 .
(2)停止加热后仍需继续通N 2,可防止倒吸和 .
(3)控制不同的温度对A中固体加热,测得装置B和C中铜网的质量变化如表.
|
温度/℃ |
室温 |
100 |
550 |
1400 |
|
B装置/g |
200.00 |
201.80 |
205.04 |
205.04 |
|
C中铜网/g |
100.00 |
100.00 |
100.00 |
101.28 |
①此黄铜矿中铜、铁元素的质量分数:ω(Cu)%= ;ω(Fe)%= .
②复杂的铁的氧化物化学式为 .

高纯硅可用于制备硅半导体材料.制备高纯硅的主要生产流程如图所示.
信息:石英砂的主要成分是SiO2,反应①化学方程式SiO2+2C Si+2CO↑
Si+2CO↑
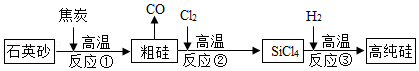
(1)石英砂属于 (填“纯净物”或“混合物”);SiCl4中硅元素的化合价为 ;写出合理处理中间产物CO的一种方法 .
(2)反应③反应除生成高纯硅外,同时还生成一种化合物.请写出此过程的化学方程式 ;
(3)反应③如果H2中混入O2,从安全角度考虑,可能引起的后果是 .
(4)若杂质不参加反应,利用反应①生产含硅质量分数为90%的粗硅2.8吨,计算至少需要焦炭多少吨?
材料是人类赖以生存和发展的重要物质,目前使用量最多的金属材料仍然是钢铁

(一)铁材料的有关知识
1.人类使用金属先后经历了"青铜"、"铁器"时代,直到近代才开始大量使用铝材料.
这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是 .
2.钢铁材料通常分为生铁和钢.如图1是我国1997年发行的纪念钢产量首次突破1亿吨的邮票.邮票通常密封保存在聚乙烯塑料袋中
①以上叙述中不涉及到的材料是 (选填序号).
A.合金 B.无机非金属材料 C.有机合成材料
②以赤铁矿为原料冶炼铁反应的化学方程式
③钢铁露置在空气中易生锈,请提出防止其生锈的一种措施 .
(二)铁及其化合物的实验
1.将Fe粉溶于稀H 2SO 4,此反应属于 (填基本反应类型).用点燃法检验生成的H 2前必须 .
2.向上述反应后的溶液中滴加NaOH溶液,生成白色Fe(OH) 2沉淀,随后沉淀变为灰绿色.
①生成Fe(OH) 2反应的化学方程式 .
②白色沉淀变为灰绿色的原因之一是部分Fe(OH) 2接触空气生成Fe(OH) 3,反应的化学方程式 .生成的Fe(OH) 3分解为Fe 2O 3.
③过滤、洗涤、低温干燥得到灰绿色固体,其组成为2FeSO 4•2Fe(OH) 2•Fe 2O 3〔相对分子质量为644].能证明固体已洗净的方法为 .
(三)灰绿色固体的热分解实验
兴趣小组称取此固体6.44g,在科研人员的指导下用如图2装置进行热分解实验.
【查阅资料】
①Fe(OH) 2在150℃~200℃时完全分解为FeO;
②FeSO 4在450℃~500℃时完全分解为Fe 2O 3,2FeSO 4 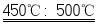 Fe 2O 3+SO 2↑+SO 3↑.
Fe 2O 3+SO 2↑+SO 3↑.
1.加热前后及过程中均通入N 2,加热前通N 2的目的是 .
2.控制温度在不同的范围对A中样品加热,测得剩余固体质量随温度的变化如图3所示.B装置中浓硫酸只能吸收SO 3和H 2O,当加热到t 1℃时,装置C中的现象为 .
①图3中E点对应的m 1= .
②图3中F点对应物质中Fe 2O 3的质量为 g.
③科研人员将F点所得剩余固体隔绝空气,在密闭容器中加热到1400℃,得到纯净的磁性Fe 3O 4.已知加热过程中发生两个反应,且反应前后固体总质量不变.请写出其中一个反应的化学方程式 .
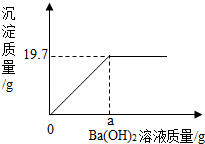
固体氢氧化钠放置在空气中容易变质转化为碳酸钠。现称取一久置于空气中的烧碱样品10.6g完全溶于蒸馏水中配成100g溶液,向其中滴加质量分数为8.55%的氢氧化钡溶液,产生沉淀与所加氢氧化钡溶液的质量关系如图所示。请通过计算回答:
(1)该烧碱样品变质的程度为 (填“部分变质”或“全部变质”)。
(2)a= g。
(3)当沉淀刚好达到最大质量时,溶液中溶质质量分数为多少?(写出计算过程,计算结果精确到0.01%)
牙膏中的摩擦剂约占牙膏成分的50%,主要用于增强牙膏对牙齿的摩擦作用和去污效果,牙膏摩擦剂一般由①CaHPO 4②CaCO 3③Al(OH) 3④SiO 2中的一种或几种组成。
(1)根据上述信息,推测牙膏中的摩擦剂应具备的性质有 (填序号)。
①易溶于水②难溶于水③坚硬④柔软⑤颗粒较大⑥颗粒较小
(2)已知某品牌牙膏中的摩擦剂是CaCO 3和SiO 2(不与稀盐酸反应)中的一种或两种物质,将适量的该牙膏溶于水、静置后过滤,向所得固体中加入足量稀盐酸,观察到的实验现象是 ,则证明该牙膏中的摩擦剂是CaCO 3和SiO 2的混合物。
(3)取20g该牙膏样品充分溶解、静置、过滤,用10%的稀盐酸测定得到的固体成分。测定过程中,剩余固体和加入稀盐酸的质量分别如图所示,试计算该牙膏中摩擦剂的质量分数是多少?
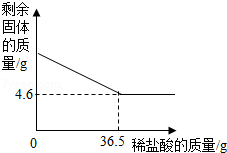
(1)向24.5g氯酸钾中加入少量二氧化锰,加热、充分反应后,生成氯化钾14.9g。则生成氧气的质量是 g,该反应的化学方程式是 。
(2)向盛有一定量硝酸银溶液的试管中加入14.9g氯化钾,恰好完全反应,过滤,得到120.2g滤液,求该硝酸银溶液的质量(写出计算步骤)
(1)向24.5g氯酸钾中加入少量二氧化锰,加热、充分反应后,生成氯化钾14.9g。则生成氧气的质量是 g,该反应的化学方程式是 。
(2)向盛有一定量硝酸银溶液的试管中加入14.9g氯化钾,恰好完全反应,过滤,得到120.2g滤液,求该硝酸银溶液的质量(写出计算步骤)
在盛有11.9g纯碱样品 ( 含少量氯化钠杂质 ) 的烧杯中加入167.8g水,完全溶解后,再向其中逐滴加入一定质量分数的氯化钡溶液,生成沉淀的总质量与所滴入氯化钡溶液质量关系如图所示:
(1)反应过程中生成沉淀的质量是 g。
(2)在B点时,溶液中含有的溶质是 (写化学式 )
(3)求A点时溶液中的所含溶质质量分数。 写出计算过程

氧气是人类生产活动的重要资源。
( 1 )下列属于 O 2 的化学性质的是 (填标号)。
| A. |
O 2能支持燃烧 |
| B. |
O 2的密度比空气的密度略大 |
| C. |
O 2在低温、高压时能变为液体或固体 |
( 2 )小圳同学进行实验室制备 O 2 的相关探究。
【 查阅 】 他得知在 KClO 3 分解制 O 2 的反应中, Fe 2 O 3 可作催化剂。
【 实验 】 他用电子秤称取 0.49g Fe 2 O 3 和一定量的 KClO 3 ,充分混合后加热至 KClO 3 完全分解,冷却至室温,称得剩余固体的质量为 1.98g 。
【计算】①剩余固体中KCl的质量是 g。
② 该反应生成 O 2 的质量(根据化学方程式写出完整的计算步骤)。
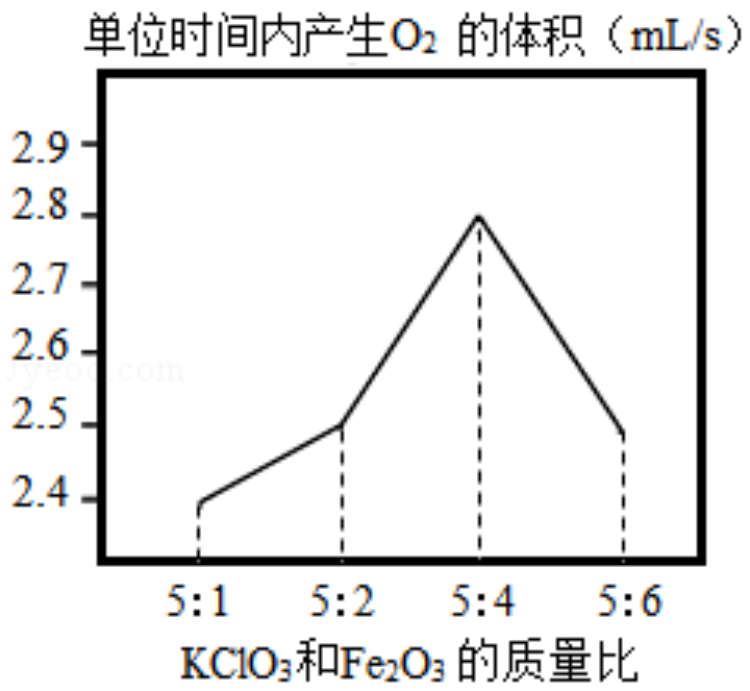
【 思考 】 他发现制备 O 2 较慢,猜测 KClO 3 和 Fe 2 O 3 的质量比可能会影响反应的快慢。
【 探究 】 ③ 他调节 KClO 3 和 Fe 2 O 3 的质量比制备 O 2 ,整理数据绘制出如图,从图中得出 KClO 3 和 Fe 2 O 3 最佳质量比是 。
【 结论 】 ④ 根据质量守恒定律,请你计算出小圳同学在 [ 实验 ] 中称取的 KClO 3 的质量为 g , KClO 3 和 Fe 2 O 3 的质量比是 (填最简比),不是最佳质量比。