医学上常用双氧水来清洗创口和局部抗菌。小美同学为了测定一瓶医用双氧水溶液的溶质质量分数,取该双氧水39g放入烧杯中,然后加入2g二氧化锰,完全反应后,称得烧杯内剩余物质的总质量为40.04g。请回答下列问题;
(1)二氧化锰在反应中的作用是 ,生成的氧气为 g。
(2)该双氧水溶液中过氧化氢的质量。(写出计算过程)
石灰石是我市主要矿产之一,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验。
| 实验步骤 |
①称取烧杯的质量 |
②将适量盐酸加入烧杯中并称重 |
③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 |
④待反应完全后,称重 |
| 实验图示 |
 |
|||
| 实验数据 |
烧杯的质量为50.0g |
烧杯和盐酸的质量为100.0g |
石灰石样品样品的质量为12.0g |
烧杯和其中混合物的质量为107.6g |
试通过分析计算:(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
现有氯酸钾和二氧化锰的混合物共26.5g,待反应不再有气体生成后,将试管冷却,得到剩余固体16.9g,求:
(1)制取氧气的质量?
(2)剩余固体中含有的各物质的质量为多少克?
某同学向过氧化氢溶液中加入二氧化锰制取氧气,相关数据如下:
| 反应前物质的质量/g |
充分反应后物质的质量/g |
|
| 过氧化氢溶液 |
二氧化锰 |
固体与液体混合物质量 |
| 68.0 |
0.1 |
66.5 |
请计算:
(1)该同学制得氧气的质量为 。
(2)该同学所用过氧化氢溶液中过氧化氢的质量。(相对原子质量:H--1 O--16)
实验室用氯酸钾和二氧化锰的混合物制取氧气,某次实验中固体的质量变化如下:

(1)生成氧气的物质的量为 mol。
(2)求参加反应的氯酸钾的物质的量。(根据化学方程式列式计算)
(3)根据题目中所给条件,判断氯酸钾是否已经完全分解? (填“是”或“否”)。
取氯酸钾和二氧化锰的混合物26g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为16 .4g。计算:
(1)生成氧气的质量
(2)原混合物中氯酸钾的质量
取氯酸钾和二氧化锰的混合物26g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为16.4g。计算:
(1)生成氧气的质量
(2)原混合物中氯酸钾的质量
(1)用氯化钠固体配制100 g溶质质量分数为12%的NaCl溶液的操作步骤为 、 、 、 。如果将这100 g溶质质量分数为12%的NaCl溶液加水稀释为4%的NaCl溶液需加水 g。
(2)某课外兴趣小组对实验室中的一瓶稀硫酸样品进行分析。他们分别用100g稀硫酸与不同质量的锌粒(含杂质,杂质不与稀硫酸反应)反应,三次实验的数据如下表。
| 实验次数 |
1 |
2 |
3 |
| 加入锌粒的质量(g) |
4 |
8 |
12 |
| 充分反应后剩余物质的总质量(g) |
103.9 |
107.8 |
111.8 |
请回答下列问题:
①第 次实验,锌粒与稀硫酸恰好完全反应。
②计算稀硫酸的质量分数(写出计算过程)。
把12.5g的大理石放入盛有34.4g稀盐酸的烧杯中,恰好完全反应后,烧杯中物质的总质量比反应前减少了4.4g。 求大理石中碳酸钙的质量分数是多少?
某实验小组为测定氯酸钾样品中氯酸钾质量分数,取一定质量的该样品与7g二氧化锰混合,其总质量为32g.加热完全分解后剩余的固体质量为22.4g。(样品中的杂质不参与化学反应)
(1)完全反应后剩余固体的成分是______________________________
(2)样品中氯酸钾的质量分数是多少?
实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na2CO3溶液。反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图甲所示。已知:BaCl2+Na2CO3=BaCO3↓+2NaCl 请计算:
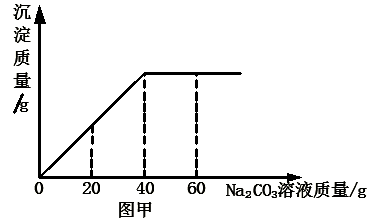
(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体 g。
(2)BaCl2溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)
有一含有纯碱的食盐样品,为了测定其中碳酸钠的含量,某同学称取30g的样品放入烧杯中,向烧杯中加入100g足量的稀盐酸,充分反应后气体全部逸出,烧杯中剩余物的总质量为123.4g(假设产生的气体全部逸出。)
(1)反应中生成的气体的质量是 g;
(2)样品中碳酸钠的质量分数是多少?