(1)配制200g质量分数10%的氯化钠溶液,需要溶质氯化钠的质量为:(列式计算)
= g
(2) 某工厂利用废铁屑和废硫酸起反应来制取回收硫酸亚铁。现有废硫酸19.6吨(H2SO4质量分数为10%),与足量的废铁屑反应,可以生产多少吨硫酸亚铁?(Fe+H2SO4= FeSO4+H2↑)
为测定某纯碱样品(含少量氯化钠杂质)中碳酸钠的含量,取12g样品放入烧杯中,加入100g稀盐酸,恰好完全反应。经测定,所得溶液常温下为不饱和溶液,其质量为107.6 g(产生的气体全部逸出)。试计算:
(1)反应生成二氧化碳的质量为 g,12g样品中碳酸钠的质量为 g。
(2)稀盐酸中溶质的质量分数(写出计算过程)。
某化学兴趣小组为了测定一工厂废水中硫酸的质量分数,取100g废水于烧杯中,加入80g质量分数为10%的氢氧化钠溶液,恰好完全反应(废水中无不溶物,其它成份不与氢氧化钠反应)。试计算废水中硫酸的质量分数。
某环保小组监测到一工厂排放的废水中含有H2SO4和CuSO4 。为了测定废水中CuSO4的质量分数,该小组取了100g废水,逐滴加入10%的NaOH溶液至过量。测得生成Cu(OH)2沉淀质量与所加NaOH溶液质量关系如下图所示。 
(1)与H2SO4反应的NaOH溶液质量为 g;100g废水中H2SO4的质量为 g。
(2)计算废水中CuSO4的质量分数。
某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
| 稀硫酸用量 |
剩余固体质量 |
稀硫酸用量 |
剩余固体质量 |
| 第一次加入10g |
mg |
第四次加入10g |
1.0g |
| 第二次加入10g |
2.0g |
第五次加入10g |
0.6g |
| 第三次加入10g |
1.5g |
第六次加入10g |
0.6g |
(1)从以上数据可知,这六次实验中,第 次加入稀硫酸时样品中的镁已经完全反应;表格中,m= 。
(2)第六次实验后,所得溶液中硫酸镁的质量分数(要求写出计算过程,结果保留到0.1%)
实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀
质量的关系曲线如图所示。

回答下列问题:
(1)从图中看出生成沉淀的最大质量是 g。
(2)开始加入碳酸钠溶液至10g时,还没有沉淀的原
因是 。
(3)计算原滤液中氯化钙的质量分数。
现将一定质量含氢氧化钠的碳酸钠固体中加入100g水充分溶解,向该溶液中逐滴加入溶质质量分数为10%的盐酸,生成气体的质量与加入盐酸的质量关系如图所示。
⑴当盐酸质量为150g时,溶液中溶质化学式为 ;
⑵求固体中碳酸钠的质量?(写出计算过程,保留一位小数)
⑶当充分反应后溶液中氯化钠的质量为 g。
为了区别氢氧化钠和氢氧化钙溶液,甲同学设计了如下图所示的四组实验方案。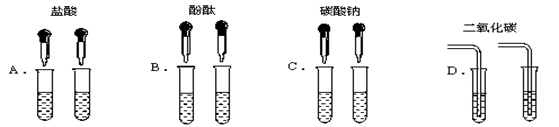
(1)其中能达到实验目的的是
(2)实验结束,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有 物质生成(填化学式),滴入酚酞后溶液呈红色。
(3)滴入酚酞后溶液呈红色,说明溶液呈碱性。使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和 三种物质中的一种,或是三种物质两两混合组成的混合物。
(4)为了验证推测,甲同学查阅资料,获悉氯化钡溶液呈中性,并设计如下实验加以验证。请根据要求完成下列空白:
| 实验内容 |
预测现象 |
结论 |
| 取少量容器中的上层溶液于试管中,加入过量的氯化钡溶液,静置 |
①若有白色沉淀,溶液呈无色 |
物质是碳酸钠 |
| ②若无沉淀生成,溶液呈红色 |
物质是氢氧化钙 |
|
| ③若有白色沉淀,溶液呈红色 |
|
(5)乙同学认为甲同学第②步验证的结论不严密,原因是 。
(6)若将一定量的Ca(OH)2溶液和100gNa2CO3溶液混合,充分反应后过滤,可得到5g白色沉淀,求该Na2CO3溶液的溶质的质量分数。
某地一辆满载浓硫酸的罐车翻倒,导致溶质质量分数为98%的浓硫酸25t泄漏,并向路基两边蔓延。接到报警后消防官兵立即赶来并用石灰浆(主要成分为氢氧化钙)中和硫酸解除了险情。请回答:
(1)溶质质量分数为98%的浓硫酸25t中含H2SO4的质量为 ;
(2)计算:中和泄漏的硫酸,理论上需要多少吨氢氧化钙?
某纯碱样品中含有一定量的食盐,为测定其中氯化钠的含量,化学小组的同学将某纯碱样品12.3g放入烧杯中,逐滴加入75g稀盐酸,恰好完全反应,待不再产生气泡时,得到84g的食盐溶液。计算原混合物中氯化钠的质量分数(CO2的溶解忽略不计)。
在潜水艇中常用过氧化钠(Na2O2)来吸收人呼出的二氧化碳气体,并产生氧气,供给人的呼吸。其反应的化学方程式为: 2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2。若一段时间内得到了16g氧气,理论上消耗过氧化钠的质量是多少?
某碳酸钠样品中含有少量氯化钠。现称量11 g该样品放入烧杯中,然后加入一
定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得
到12.1g氯化钠固体。计算:
(1)碳酸钠样品中碳酸钠的质量
(2)反应后所得溶液中溶质的质量分数。(结果精确到0.1%)
某化学兴趣小组同学对含有Na2SO4杂质的Na2CO3固体样品进行了以下实验探究。请根据下图所示的实验过程和提供的数据,回答以下问题。
(1)过程②中产生气体的原因是______。
(2)计算溶液A的质量(写出计算过程,结果保留一位小数)。
某同学做了如下图所示的实验,在14.6%的稀盐酸中加入碳酸钙,后加入10.6%的碳酸钠溶液
| |
第一次 |
第二次 |
| 14.6%的稀盐酸的质量 |
m |
m |
| 加入碳酸钙的质量 |
10g |
20g |
| 加入10.6%的碳酸钠溶液的质量 |
100g |
200g |
| 加入碳酸钠溶液后,实验现象 |
只有气泡 |
只有白色沉淀 |
若第二次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题
写出实验一中发生化学反应的方程式
第一次实验中加入碳酸钙后溶液中溶质成分
根据已知条件列出求解第二次实验生成沉淀的质量的比例式
实验中加入稀盐酸m的质量为
若若用溶质质量分数29.2%的浓盐酸配置实验二所需的稀盐酸,则需要加水的质量
将第二次反应后的溶液蒸发191.2g水,则所得不饱和溶液中溶质的质量分数为 。
将一定质量的氯化钠和碳酸钠的混合物加水溶解,再向此溶液中加入50g一定溶质质量分数的稀盐酸,恰好完全反应.经数据分析可知放出气体4.4g,经测定,滤液中含氯元素的质量21.3g(假定物质质量无损失).求:
(1)所加稀盐酸的溶质质量分数.
(2)原固体混合物中氯化钠的质量.