化学课堂上学生探究了如图所示的几个实验:
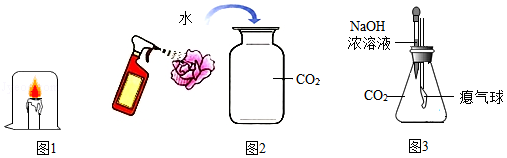
(1)图1实验中,蜡烛熄灭的原因是 。
(2)图2实验中,使紫色干花(用石蕊溶液浸泡过)变红的物质是 (填化学式)。
(3)图3实验中,滴入氢氧化钠浓溶液后,可观察到的实验现象是 ,发生反应的化学方程式是 。
请同学们用如图装置完成相应气体的制取。

【资料】已知氨气是一种密度比空气小、极易溶于水且有刺激性气味的气体。以下两个反应均可产生氨气:
①碳酸氢铵受热分解:NH4HCO3 H2O+CO2↑+NH3↑
H2O+CO2↑+NH3↑
②熟石灰与氯化铵固体共热:Ca(OH)2+2NH4Cl CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
【解决问题】
(1)实验室若用加热熟石灰与氯化铵固体混合物的方法制氨气,其发生装置可选用上述装置中的 (填字母代号),在用D装置收集氨气时可在a端放置一团蘸有酚酞试液的湿棉花,以便 。在选择制取氨气的反应原理时,选用反应②而不选用反应①的理由是 。
(2)上述装置中X仪器的名称为 ,请写出一个用A装置制氧气的反应的化学方程式 。
CO 2是如何被发现的?化学家又是如何研究它的性质?让我们重温这段历史。
(1)17世纪初,比利时化学家海尔蒙特研究发现,木炭燃烧后,有灰烬还有不可见的气体产生,烛火在该气体中会熄灭。另外他还在地窖、洞穴等地发现过这种气体。"烛火在该气体中会熄灭"和出现在"地窖、洞穴等地"说明这种气体具有 的性质。
(2)1755年,英格兰化学家布莱克做了如下实验:煅烧白垩(石灰石),将煅烧生成的固体与水反应,反应后的物质与煅烧生成的气体又结合成白垩。他将这种固定在白垩中的气体叫作"固定气体"。

实验②中所发生反应的化学方程式为 。
实验③中所发生反应的化学方程式为 。
(3)1766年,英国化学家卡文迪许实验测得:一定温度下,1体积水能溶解比1体积稍多的"固定气体"。1774年,德国化学家伯格曼将石蕊溶液滴到溶有CO 2的水中,石蕊溶液由紫色变成微红色。当时已经发现石蕊溶液是一种酸碱指示剂。卡文迪许和伯格曼两位化学家的实验说明CO 2不仅能溶于水,还可与水反应。CO 2与水反应的化学方程式为 。
请根据如图实验装置图回答有关问题:

(1)写出标号仪器的名称:① ,② .
( 2)用AE组合制取氧气.有关反应的化学方程式为 ;在气体收集完毕后,接下来的操作是 .
(3)实验室制取二氧化碳用稀盐酸而不用浓盐酸,是因为浓盐酸具有 .常用石灰水检验二氧化碳气体,有关反应的化学方程式是 .
(4)乙炔是一种微溶于水的气体,密度与空气接近,实验室常用块状电石和水在常温下反应制取乙炔.制取乙炔的发生装置选 ,收集装置选 .
实验是化学研究的基础,结合下列实验装置及图示回答问题。
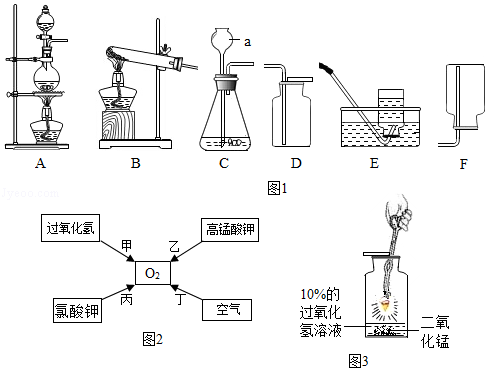
(1)图中a的仪器名称是 。
(2)"绿色化学"要求利用化学原理从源头上消除污染,实验室制取氧气的方法中最能体现绿色化追求的途径是 (填编号),该反应的化学方程式是 。
(3)若用二氧化锰和双氧水混合加热制备氧气,应选择的发生装置和收集装置的组合是 (填字母编号)。
(4)做铁丝在氧气中燃烧的实验改进如图3所示,其优点是实验简便、保证安全和 。
阅读科普短文,回答相关问题。
钠元素在自然界中分布很广,储量极为丰富,常以氯化钠、碳酸钠、硫酸钠等物质存在。
19世纪初,英国化学家戴维在实验室中首次制得了金属钠。
钠是一种银白色金属,质软,密度为0.97g•cm﹣3,熔点为97.8℃。金属钠的性质很活泼,能与许多物质发生化学反应。钠暴露在空气中,与氧气反应生成氧化钠(Na2O),钠在空气中燃烧,生成淡黄色的过氧化钠(Na2O2);钠遇水立即发生剧烈反应,生成氢氧化钠和氢气。因此,实验室常将钠保存在煤油中。
金属钠的用途广泛。钠和钾形成的合金熔点低,常温下呈液态,可用作快中子反应堆的热交换剂。利用钠的强还原性,在一定条件下可以将钛(Ti)、锆(Zr)等稀有金属从其氯化物中置换出来。
工业上通常采用电解熔融氯化钠的方法制取单质钠。
(1)自然界中钠元素以 (填“单质”或“化合物”)形式存在。
(2)钠保存在煤油中,是为了防止钠与空气中的 反应而变质。
(3)过氧化钠中的阴离子为O22﹣,1个O22﹣离子含有的电子数为 。
(4)钠钾合金用作快中子反应堆的热交换剂,利用钠钾合金良好的 (填字母)。
a.导电性
b.导热性
c.延展性
(5)写出高温下钠与四氯化钛反应的化学方程式: 。
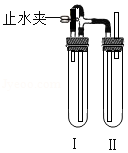
氢氧化亚铁是白色难溶于水的物质,若接触到空气迅速被氧化,转化成红褐色的氢氧化铁。化学反应方程式为:4Fe(OH) 2+O 2+2H 2O=4Fe(OH) 3,某化学兴趣小组利用实验室提供的药品:铁屑、稀硫酸、氢氧化钠溶液以及如图装置进行实验,观察到产生了白色的氢氧化亚铁沉淀。请回答下列问题:
(1)对于反应4Fe(OH) 2+O 2+2H 2O=4Fe(OH) 3,它的化学反应基本类型是 ,其中化合价升高的元素为 。(写元素名称)
(2)配制药品的蒸馏水需要加热煮沸,解释原因 。
(3)实验得到氢氧化亚铁涉及到的化学方程式有:
①Fe+H 2SO 4═FeSO 4+H 2↑
② 。(写出化学方程式)
(4)试管Ⅰ中加入的药品为 ,试管Ⅱ中加入的药品为 。(均写名称)
(5)请将缺少的实验步骤补全:如图连接好仪器→检查装置气密性→装入药品迅速塞紧塞子→打开止水夹→ ,很快观察到白色沉淀在 试管中产生(填"Ⅰ"或"Ⅱ")。
小明在冬天输液时发现护士在输液管上加了一个如图所示的装置,护士告诉他这是一次性输液加热棒,可以消除药液温度与体温的差异。加热棒里的成分到底是什么呢?科学研究小组通过上网查阅资料发现:一次性输液加热棒内的主要成分是还原性铁粉、炭粉和氯化钠等物质。该加热棒内是否真的含有这几种物质呢?科学研究小组设计了如下实验:

(1)探究加热棒内是否含有氯化钠
①将加热棒内的物质放入烧杯中,加入足量的水充分溶解、过滤,得到滤渣和滤液。
②取适量滤液于试管中,滴加适量的硝酸钡溶液和稀硝酸,无明显现象,
(填写正确的实验操作及现象),证明滤液中含有Cl﹣。
在老师的指导下通过进一步的实验证明滤液中还含有Na+,从而确定含有氯化钠。
(2)探究加热棒内是否含有铁粉
小明用磁铁靠近滤渣,发现部分黑色粉末被吸引。但被吸引的黑色物质也有可能是四氧化三铁。
小明通过如图装置探究黑色物质是否含有四氧化三铁,该物质鉴定的原理是:Fe3O4+4H2 3Fe+4H2O。
3Fe+4H2O。

当观察到 这一现象时,排除了四氧化三铁存在的可能性。
小英同学认为这还不能确定铁粉的存在,因为除了四氧化三铁外,钴粉、镍粉也是能被磁铁吸引的黑色粉末。研究小组的同学在查阅资料的基础上,进行如下实验:取适量被吸引的黑色物质于试管中,加入足量的稀盐酸,充分反应后,向试管中加入足量的过氧化氢溶液(能将Fe2+转化为Fe3+),然后滴加硫氰化钾溶液。溶液变为血红色,证明溶液中有Fe2+,得出加热棒中含有铁粉这一结论。
(3)探究加热棒内是否含有炭粉
点燃不能被吸引的黑色粉末,并将产生的气体通入足量澄清石灰水,石灰水变浑浊,得出加热棒内含有炭粉这一结论。请写出此操作过程中确认炭粉存在的化学方程式: 、 。
综合上述实验,小明验证了加热棒内的主要成分。
加热棒为什么能够起到加热作用呢?小明还将进一步探究。
下列装置常用于实验室制取气体。
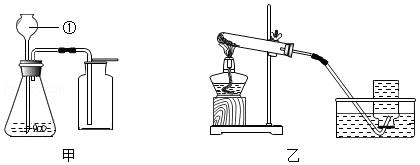
(1)仪器①的名称是 。
(2)用装置甲制取氧气,采用该收集方法的依据是 。用收集的氧气做铁丝燃烧实验,应预先在集气瓶中加入少量的 。
(3)用装置乙制取气体,实验结束时,为防止水槽里的水倒流,应采取的操作是 。
(4)在加热条件下,用醋酸钠(CH3COONa)固体与碱石灰中氢氧化钠反应制取甲烷,同时生成碳酸钠,应选用的装置是 (填“甲”或“乙”),反应的化学方程式为 。
酸、碱、盐及氧化物在生产、生活中应用广泛,使用时必须规范科学。请你根据它们的性质回答下列问题:
(1)有Ba(OH) 2溶液、稀H 2SO 4、Ba( NO 3) 2溶液、石灰石、小苏打、熟石灰等六种物质,其中常用于改良酸性土壤的是 ;写出其中能发生中和反应的化学方程式: 。
(2)实验室有三瓶失去标签的试剂:稀HCl、NaOH溶液、CuSO 4溶液,不用其他任何试剂就可将它们鉴别出来,其中最先鉴别出来的物质是 ,写出鉴别过程中发生反应的化学方程式 。
(3)NaOH溶液、澄清石灰水在空气中长期敞口放置易变质,写出NaOH在空气中变质的化学方程式 ,要除去已变质的澄清石灰水中少量的杂质,采用的有效方法是 。
钨(W)是一种重要的战略金属。实验室需用干燥的H2还原WO3制备金属W,所用装置如图所示。已知Zn粒中往往含有ZnS杂质,焦性没食子酸溶液可用于吸收氧气。回答下列问题:
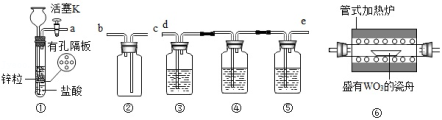
(1)装置①中用到的仪器有长颈漏斗、带导管的橡胶塞和 ,其反应的化学方程式有: 、ZnS+2HCl═ZnCl2+H2S↑。
(2)装置②的作用是安全瓶防倒吸,则a连接 (选填b、c、d或e)。
(3)装置③中盛装NaOH溶液,其作用是 。
(4)装置④⑤中盛装的溶液依次是 、 。
(5)装置①是启普发生器的简易装置,关闭活塞K后装置①中反应很快停止,其原因是 。
“珍爱生命,远离毒品”,冰毒是一种危害性很大的毒品,其主要成分是甲基苯丙胺(化学式为C10H15N)。某化学学习小组模拟对毒品的销毁,利用所制得的氧气燃烧冰毒,并检验所生成的二氧化碳气体,设计了如图实验。

本次实验只提供了如下化学试剂:5%的过氧化氢溶液,二氧化锰固体,浓硫酸,NaOH溶液,Ca(OH)2溶液,冰毒。请回答下列问题:
(1)仪器a的名称是 。
(2)为了完成此实验,除了选择装置B以外,还应选择的装置组合是 (填装置序号字母)。
(3)连接好装置,在加入药品前还必须进行的操作是 。
(4)检验二氧化碳时所发生反应的化学方程式为 。
如图装置可用于实验室制取常见的气体
(1)仪器A的名称是 ;气球的作用是 .
(2)制取O2.Y是 ;实验时,气球先变大,后变小.先变大的原因有:①反应生成了气体,气体进入气球;② .
(3)制取CO2.写出有关反应的化学方程式 .
(4)制取H2.现取足量的粗锌加入到25g稀硫酸中,充分反应后,产生0.1g氢气,则所用稀硫酸中溶质的质量分数为多少?(写出计算过程)

实验室常用块状大理石和稀盐酸制取CO 2气体。
(1)写出实验室制取CO 2的化学方程式: 。
(2)若用右图所示装置(固定装置省略)制CO 2:.连接好装置后,需检查装置的气密性。具体操作方法是:先 (填字母,下同),后 若导管口有气泡,放手后导管内上升一段稳定的水柱,则气密性良好。
A.用手捂住试管 B.将导管一端浸入水中
(3)实验室收集CO 2可用的方法是 (填字母)。
A.排水法 B.向下排空气法 C.向上排空气法
(4)实验室常用澄清石灰水检验CO 2,写出反应的化学方程式: 。
(5)某些大理石中含少量硫化物,使制得的CO 2中混有H 2S气体。欲获取纯净、干燥的CO 2,需对发生装置中产生的气体进行除杂,实验装置如下:
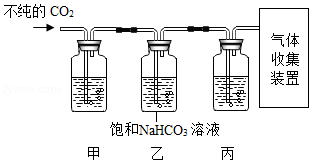
查阅资料:I.H 2S能与NaOH等碱溶液、CuSO 4溶液反应。
Ⅱ.CO 2中混有的HCl气体可用饱和NaHCO 3溶液吸收。
①装置甲中所盛试剂应选用 (填字母)。
A.浓硫酸 B.NaOH溶液 C.澄清石灰水 D.CuSO 4溶液
②装置丙的作用是 。
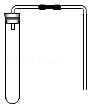
碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究。
【猜想】Mg(OH)Cl分解后产物可能有:Mg、MgCl 2、MgO、HCl气体、H 2O、Cl 2。
【实验一】取少量的Mg(OH)Cl放入大试管中,按如图所示装置进行实验,加热过程中观察到足量硝酸银溶液中有白色沉淀产生,一段时间后,沉淀不再产生,大试管口也没有液滴形成,管内有固体剩余,无其他现象。由此推知Mg(OH)Cl分解后产物中有 气体,无其他气体。
【实验二】取少量实验一的剩余固体于试管中,加入足量稀盐酸,没有气泡产生,由此推知Mg(OH)Cl分解后产物中没有 。
【实验三】再取少量实验一的剩余固体,加入足量稀硝酸,固体全部溶解,再滴入AgNO 3溶液,无沉淀产生,由此推知Mg(OH)Cl分解后产物中没有 。
【结论】Mg(OH)Cl受热分解的化学反应方程式为 。
