“珍爱生命,远离毒品”,冰毒是一种危害性很大的毒品,其主要成分是甲基苯丙胺(化学式为C10H15N)。某化学学习小组模拟对毒品的销毁,利用所制得的氧气燃烧冰毒,并检验所生成的二氧化碳气体,设计了如图实验。

本次实验只提供了如下化学试剂:5%的过氧化氢溶液,二氧化锰固体,浓硫酸,NaOH溶液,Ca(OH)2溶液,冰毒。请回答下列问题:
(1)仪器a的名称是 。
(2)为了完成此实验,除了选择装置B以外,还应选择的装置组合是 (填装置序号字母)。
(3)连接好装置,在加入药品前还必须进行的操作是 。
(4)检验二氧化碳时所发生反应的化学方程式为 。
我国“十四五”规划已经明确“2030年前实现碳达峰”的目标。碳达峰是指二氧化碳的排放达到峰值,不再增长。如图为自然界中CO2的循环图,图中箭头指向表示产生(排放)或消耗CO2的途径。回答下列问题:
(1)途径①需要消耗空气中的 。
(2)途径②中,枯枝败叶中的纤维素[化学式为(C6H10O5)n]在微生物作用下彻底转化为CO2和H2O,该转化中消耗O2与产生的CO2分子个数比为 。
(3)途径④通过光合作用吸收CO2的量白天 夜晚(填“大于”或“小于”)。

(4)途径⑤消耗的化石燃料是 (填“可”或“不可”)再生资源。
(5)降碳的一种途径是在合适的催化剂条件下,将二氧化碳与氢气反应使碳全部转化为乙烯(C2H4)、同时生成另一种化合物。请写出反应的化学方程式 。
(6)某年通过不同途径产生或消耗碳量的相对值如下表所示:
途径 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
相对值 |
0.6 |
60 |
60 |
121.8 |
5.5 |
92 |
90 |
据表可知,这一年大气中碳量增加了 (用表中相对值计算)。为达成“2030年前实现碳达峰”的目标,下列措施不可行的是 。
A.开发新能源
B.植树造林
C.禁止使用化石燃料
进一步分析上表回答:人口增多是否是大气中碳量增加的主要因素,并说明理由 。
钨(W)是一种重要的战略金属。实验室需用干燥的H2还原WO3制备金属W,所用装置如图所示。已知Zn粒中往往含有ZnS杂质,焦性没食子酸溶液可用于吸收氧气。回答下列问题:
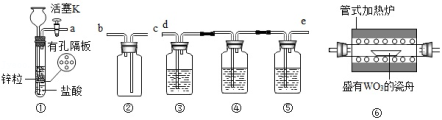
(1)装置①中用到的仪器有长颈漏斗、带导管的橡胶塞和 ,其反应的化学方程式有: 、ZnS+2HCl═ZnCl2+H2S↑。
(2)装置②的作用是安全瓶防倒吸,则a连接 (选填b、c、d或e)。
(3)装置③中盛装NaOH溶液,其作用是 。
(4)装置④⑤中盛装的溶液依次是 、 。
(5)装置①是启普发生器的简易装置,关闭活塞K后装置①中反应很快停止,其原因是 。
请同学们用如图装置完成相应气体的制取。

【资料】已知氨气是一种密度比空气小、极易溶于水且有刺激性气味的气体。以下两个反应均可产生氨气:
①碳酸氢铵受热分解:NH4HCO3 H2O+CO2↑+NH3↑
H2O+CO2↑+NH3↑
②熟石灰与氯化铵固体共热:Ca(OH)2+2NH4Cl CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
【解决问题】
(1)实验室若用加热熟石灰与氯化铵固体混合物的方法制氨气,其发生装置可选用上述装置中的 (填字母代号),在用D装置收集氨气时可在a端放置一团蘸有酚酞试液的湿棉花,以便 。在选择制取氨气的反应原理时,选用反应②而不选用反应①的理由是 。
(2)上述装置中X仪器的名称为 ,请写出一个用A装置制氧气的反应的化学方程式 。
实验室制取X气体,该气体为氢气、氧气、氯气(Cl2)中的一种。根据如图回答问题:
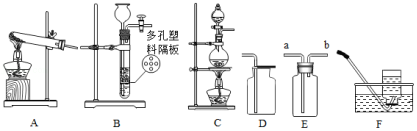
(1)用高锰酸钾制取并收集氧气:
①该反应的化学方程式为 ;
②用D装置收集氧气,检验收集满的方法 ;
③改用E装置(如图放置)收集氧气,气体应从 端(填“a”或“b”)通入;
(2)①实验室制取并收集氢气,可选用发生装置 (填字母)和收集装置F的组合;
②实验室常用二氧化锰粉末和浓盐酸在加热条件下制取氯气,可选用的发生装置为
(填字母)。
回答下列问题。
(1)某兴趣小组参观火力发电厂,了解到废气中的SO2、NO2、CO、CO2会影响环境,设计如图流程处理废气。
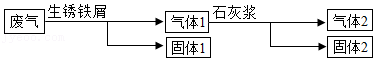
①用生锈铁屑处理废气中的CO,体现CO 性。
②用石灰浆不用石灰水的原因是 。
③固体2中有 (写两种物质)。
(2)A~D为初中化学常见物质,转化关系如图。A是由两种元素组成的钙盐,C是火力发电厂排放的温室气体。
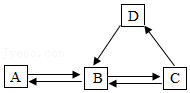
①B转化为A的化学方程式为 。
②若D广泛用于玻璃、洗涤剂的生产,则D转化为B的基本反应类型是 ;检验D中阴离子的方法是 。
③将足量C通入石蕊溶液中,现象是 ;测得该溶液pH=4,加热至90s时C完全排出,画出加热过程pH变化图像。
实验室用氯酸钾和二氧化锰制氧气,并回收产物。
(1)氯酸钾制氧气的化学方程式为 ,制取装置需铁架台、水槽和
(填序号)。
(2)收集气体时,待集气瓶里的水排完后, (填操作),把集气瓶移出水槽,正放在桌上。
(3)将完全反应后的固体溶解、过滤、洗涤、蒸发,以上操作都用到的仪器名称是 。蒸发时需铁架台和 (填序号),当 时停止加热。
(4)产物KCl可作化肥,对植物的主要作用是 (填序号)。
a.促进叶色浓绿
b.增强抗寒抗旱能力
c.增强抗倒伏能力
化学是一门以实验为基础的科学。以下为初中化学常见实验,按要求回答问题。
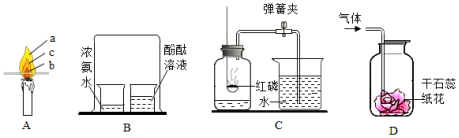
(1)图A木条放在蜡烛火焰上片刻后 (填序号)处炭化程度最大。
(2)图B发现酚酞溶液变红,说明分子的性质是 。
A.分子很小
B.分子在不断运动
C.分子之间有间隙
(3)图C红磷燃烧的化学方程式为 ,实验结束后,吸入左瓶的水量明显小于左瓶空气体积的 ,可能原因是 (填序号)。
A.红磷过量
B.气密性不好
C.燃烧完成后未冷却到室温打开止水夹
(4)图D气体是实验室制取的CO 2,发现干石蕊纸花变红,可能原因是 (写一条即可)。
氧气的制取和性质是初中化学的重要内容,根据如图所示的装置回答问题。

(1)仪器a常用 (填"内焰""外焰"或"焰心")加热。
(2)用H 2O 2溶液和MnO 2制取O 2的化学方程式为 。实验室里欲制取和收集一瓶干燥的O 2,需选用的装置是 (填序号)。
(3)装置E中水的作用是 。
(4)若将铁丝改为少量木炭进行实验,为了检验产物,可将水换成 (填名称)。
小明在冬天输液时发现护士在输液管上加了一个如图所示的装置,护士告诉他这是一次性输液加热棒,可以消除药液温度与体温的差异。加热棒里的成分到底是什么呢?科学研究小组通过上网查阅资料发现:一次性输液加热棒内的主要成分是还原性铁粉、炭粉和氯化钠等物质。该加热棒内是否真的含有这几种物质呢?科学研究小组设计了如下实验:

(1)探究加热棒内是否含有氯化钠
①将加热棒内的物质放入烧杯中,加入足量的水充分溶解、过滤,得到滤渣和滤液。
②取适量滤液于试管中,滴加适量的硝酸钡溶液和稀硝酸,无明显现象,
(填写正确的实验操作及现象),证明滤液中含有Cl﹣。
在老师的指导下通过进一步的实验证明滤液中还含有Na+,从而确定含有氯化钠。
(2)探究加热棒内是否含有铁粉
小明用磁铁靠近滤渣,发现部分黑色粉末被吸引。但被吸引的黑色物质也有可能是四氧化三铁。
小明通过如图装置探究黑色物质是否含有四氧化三铁,该物质鉴定的原理是:Fe3O4+4H2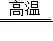 3Fe+4H2O。
3Fe+4H2O。

当观察到 这一现象时,排除了四氧化三铁存在的可能性。
小英同学认为这还不能确定铁粉的存在,因为除了四氧化三铁外,钴粉、镍粉也是能被磁铁吸引的黑色粉末。研究小组的同学在查阅资料的基础上,进行如下实验:取适量被吸引的黑色物质于试管中,加入足量的稀盐酸,充分反应后,向试管中加入足量的过氧化氢溶液(能将Fe2+转化为Fe3+),然后滴加硫氰化钾溶液。溶液变为血红色,证明溶液中有Fe2+,得出加热棒中含有铁粉这一结论。
(3)探究加热棒内是否含有炭粉
点燃不能被吸引的黑色粉末,并将产生的气体通入足量澄清石灰水,石灰水变浑浊,得出加热棒内含有炭粉这一结论。请写出此操作过程中确认炭粉存在的化学方程式: 、 。
综合上述实验,小明验证了加热棒内的主要成分。
加热棒为什么能够起到加热作用呢?小明还将进一步探究。
“垃圾是放错的资源”。碘循环工艺不仅能吸收SO2,减少环境污染,而且还可以得到仅含一种元素的化工原料X,流程如图所示:

(1)流程中可循环利用的物质是 。
(2)膜反应器中发生的是分解反应,X的化学式是 。
(3)反应器中发生反应的化学方程式为 。
如图是实验室常用的实验装置,请回答下列问题。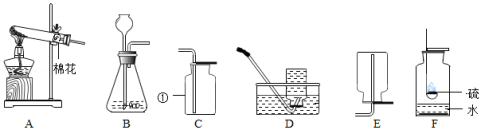
(1)仪器①的名称是 。
(2)若用高锰酸钾制取氧气选取的发生装置是 (填字母),写出该反应的化学方程式 。
(3)能用D装置收集氧气是因为氧气具有 且不与水反应的性质。
(4)将收集的氧气用作性质实验,如图F所示,水的作用是 。写出F装置中发生的化学反应方程式 。
(5)氢气是一种清洁能源。实验室用锌粒和硫酸反应制取氢气,应选择的发生装置是 (填字母,下同),收集装置除选D外,还可以选 。
金属在生产和生活中的应用极为广泛。
(1)生铁和钢是两种含碳量 的铁合金(填“相同”或“不同”)。
(2)下列生活用品利用金属良好导热性的是 (填序号)。
A.镀铬水龙头
B.铸铁暖气片
C.黄铜钥匙
(3)我国古代很早就认识到铜盐溶液里的铜能被铁置换,这一方法是湿法冶金技术的起源。铁与硫酸铜溶液反应的化学方程式为 。
(4)焊接钢轨的反应原理是铝与氧化铁在高温条件下反应生成铁和氧化铝,该反应的化学方程式为 。
(5)已知氧化镁和氧化铝都能与酸反应生成盐和水。现有氧化镁、氧化铝和铁的混合物9.9g,向其中加入245g质量分数为10%的稀硫酸,恰好完全反应,得到254.8g溶液,则原混合物中氧化镁的质量为 g。
根据下列装置图回答问题。
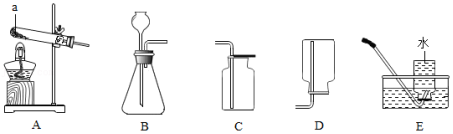
(1)写出仪器a的名称: 。
(2)实验室用高锰酸钾制取并收集氧气,应选用的装置为 (填序号),反应的化学方程式为 。
(3)实验室用大理石和稀盐酸制取并收集二氧化碳,应选用的装置为 (填序号),反应的化学方程式为 。
某兴趣小组为探究甲烷的元素组成,经查询资料,采用如图所示装置,制取并收集一定量甲烷气体进行实验。
【查询资料】
Ⅰ.甲烷是一种无色无味的气体,密度比空气小,难溶于水、有可燃性。
Ⅱ.实验室常用醋酸钠和碱石灰固体共热制取甲烷,有关反应的化学反应方程式:CH3COONa+NaOH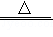 Na2CO3+CH4↑。
Na2CO3+CH4↑。
【实验装置】
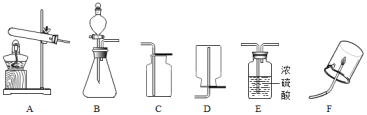
请回答:
(1)实验室制取甲烷气体应选用的发生装置是 (填序号,下同),收集装置是 ;
(2)验纯后,点燃甲烷气体,在火焰上方罩一冷而干燥的烧杯(见图F),烧杯内壁有
生成,然后向烧杯中倒入少量澄清石灰水,振荡,现象为 。由此推断,甲烷中一定含C、H两种元素,甲烷燃烧的化学反应方程式为 ;
(3)进行实验(2)前,将甲烷气体通过装置E,目的是 。