下列装置常用于实验室制取气体。
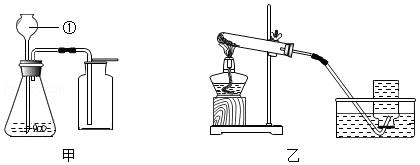
(1)仪器①的名称是 。
(2)用装置甲制取氧气,采用该收集方法的依据是 。用收集的氧气做铁丝燃烧实验,应预先在集气瓶中加入少量的 。
(3)用装置乙制取气体,实验结束时,为防止水槽里的水倒流,应采取的操作是 。
(4)在加热条件下,用醋酸钠(CH3COONa)固体与碱石灰中氢氧化钠反应制取甲烷,同时生成碳酸钠,应选用的装置是 (填“甲”或“乙”),反应的化学方程式为 。
某小组利用如图装置制备CO2,并模拟自然界中CO2的循环。回答下列问题。
(1)装置B中仪器①的名称是 。
(2)实验室用稀盐酸和石灰石制取CO2,反应的化学方程式为 ,发生装置是 (填字母序号)。
(3)为制得CO2的水溶液,CO2应从装置C的 (填“m”或“n”)端通入。
(4)将CO2的水溶液转移至烧杯,并组装装置如图D所示,置于阳光下一段时间,观察到有气泡产生,检验该气体的方法是 。
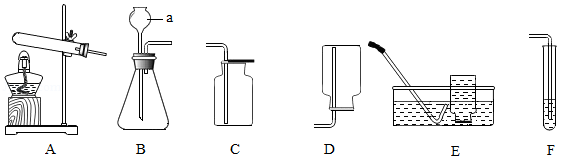
如图A~H是实验室制取某些常见气体的装置示意图。请完成下列相关问题。 
(1)写出图中仪器②的名称 ;
(2)实验室要制取一瓶干燥的氧气所选择的装置是 (填序号);
(3)实验室制备CO 2的化学方程式为 ,若用装置H收集CO 2气体,产生的气体应从 (填"a"或"b")端通入;
(4)用石灰石和稀盐酸制取二氧化碳,选取装置C或D相对于装置B在操作方面的优势为 ;若选择装置D用双氧水和二氧化锰制备氧气,能否体现该优点 (填"能"或"否");
(5)用排水法与排空气法收集CO 2及相关性质的比较(分别用体积相同的2个集气瓶收集)。
已知:向收集满CO 2的集气瓶内倒入等体积适量澄清石灰水,并振荡。二氧化碳纯度越高,澄清石灰水先变浑浊后变澄清的时间越短。
| 比较项目 |
排水法 |
向上排空气法 |
| 收集方法可行性分析 |
CO 2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率。 |
,且不与空气发生反应。 |
| 收集过程分析 |
集满现象: 。 |
"验满"分析:因气体无色,是否集满难确定,即便用燃着的木条移近容器口熄灭,也难以证明空气完全排尽。 |
| 石灰水变浑浊又变澄清所需时间分析 |
时间较短。 |
时间较长。 |
由上述实验可得结论:①二氧化碳可用排水法或向上排空气法收集;
②与排空气法相比,排水法的优点是 。
航空航天技术是一个国家科技、工业和国防实力的重要体现。南京理工大学陈光教授团队研究成功的"PST高温TiAl合金单晶"大幅度提高了耐高温性能,显著改善了材料塑性,对于新型轻质高温结构材料的发展和应用具有非常重要的意义。"PST TiAl单晶"实现了高强高塑的优异结合,持久寿命优于已经成功应用于GEnx发动机的4822合金1~2个数量级,有望将目前TiAl合金的使用温度从650~750℃提高到900℃以上,其抗压能力是第四代单晶合金的3倍,有了这种材料技术,中国也能够制造出世界一流的航空发动机。
(1)关于TiAl合金单晶的说法错误的是 。
A.TiAl合金属于单质
B."PST TiAl单晶"密度小、耐高温、强度大、可塑性强
C."PST TiAl单晶"持久寿命明显优于4822合金
D.钛和钛合金被认为是21世纪的重要金属材料,医疗上可用来制造人造骨等
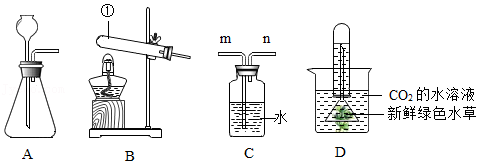
(2)工业上常用铝土矿(主要成分为Al 2O 3,含Fe 2O 3杂质)为原料冶炼铝,工艺流程如图。请回答下列问题。
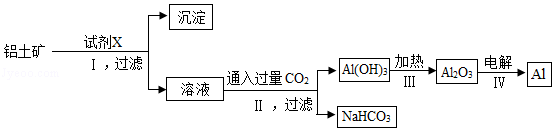
已知:氧化铝与酸、碱都能发生反应;
氧化铝与氢氧化钠溶液反应的化学方程式为Al 2O 3+2NaOH═2NaAlO 2+H 2O。
①试剂X是 (填"氢氧化钠溶液"或"盐酸"),反应Ⅰ后过滤所得的沉淀是 。
②Ⅱ中反应的化学方程式是 ;
③列举产物NaHCO 3的一种用途 ;
④电解氧化铝的化学方程式是 。
实验室制取气体时需要的部分装置如图所示,请回答下列问题。
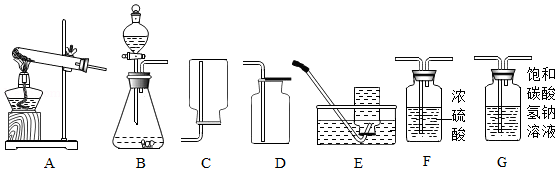
【信息】二氧化碳不易溶于饱和碳酸氢钠溶液。
(1)实验室中可用过氧化氢溶液与二氧化锰制取氧气,反应的化学方程式为 ,应选用的发生装置是 (选填装置字母序号)。
(2)实验室中用石灰石和稀盐酸制取一瓶干燥、纯净的二氧化碳气体,所选装置的连接顺序为:气体发生装置→ → →D(选填装置字母序号)。
(3)确定实验室制取气体的反应原理时,下列因素中不需要考虑的是 (选填字母序号)。
| A. |
药品容易获得,能生成所要制取的气体 |
| B. |
反应条件易于控制,反应速率适中 |
| C. |
操作简便易行,安全可靠,节能环保 |
| D. |
所要制取气体的颜色和气味 |
酸、碱、盐是我们身边重要的化合物。请根据所学知识回答相关问题:
(1)随着新能源汽车的发展,动力电池领域对氢氧化锂的需求量越来越大。氢氧化锂(LiOH)与氢氧化钠化学性质相似,其原因是溶液中都有 (填离子符号)。
(2)盐酸可用于金属表面除锈,请写出盐酸除铁锈的化学方程式 。
(3)波尔多液是由硫酸铜和石灰乳等配成的杀菌剂。喷洒波尔多液后,果蔬表面有一些蓝色斑点(一种难溶性碱),蓝色斑点的成分是 (填化学式)。
(4)下列试剂能将稀盐酸、氯化钠溶液、澄清石灰水三种溶液一次鉴别出来的是 (填序号)。
A.稀硫酸
B.酚酞溶液
C.碳酸钠溶液
化学课堂上学生探究了如图所示的几个实验:
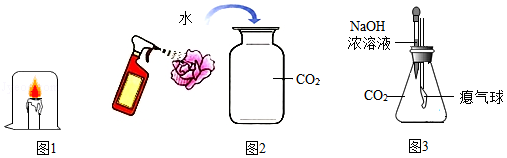
(1)图1实验中,蜡烛熄灭的原因是 。
(2)图2实验中,使紫色干花(用石蕊溶液浸泡过)变红的物质是 (填化学式)。
(3)图3实验中,滴入氢氧化钠浓溶液后,可观察到的实验现象是 ,发生反应的化学方程式是 。
(1)从图中选择合适的仪器,组装成制取氧气的发生装置,且能够随时添加药品,所选仪器应是 (填序号)。适用于这种装置制取氧气的化学方程式为 。

(2)生活中,有许多物品的使用与实验室中仪器的作用相似。请在图中选择作用相似的仪器,将其名称填入下表中对应的位置。
| 生活物品 |
物品的使用 |
作用相似的仪器名称 |
| 酒瓶 |
盛放白酒 |
|
| 洗脸盆 |
盛放清水 |
|
| 两根筷子 |
夹取盘中的青菜 |
|
| 一根筷子 |
水中放入白糖,搅拌 |
|
CO 2是如何被发现的?化学家又是如何研究它的性质?让我们重温这段历史。
(1)17世纪初,比利时化学家海尔蒙特研究发现,木炭燃烧后,有灰烬还有不可见的气体产生,烛火在该气体中会熄灭。另外他还在地窖、洞穴等地发现过这种气体。"烛火在该气体中会熄灭"和出现在"地窖、洞穴等地"说明这种气体具有 的性质。
(2)1755年,英格兰化学家布莱克做了如下实验:煅烧白垩(石灰石),将煅烧生成的固体与水反应,反应后的物质与煅烧生成的气体又结合成白垩。他将这种固定在白垩中的气体叫作"固定气体"。

实验②中所发生反应的化学方程式为 。
实验③中所发生反应的化学方程式为 。
(3)1766年,英国化学家卡文迪许实验测得:一定温度下,1体积水能溶解比1体积稍多的"固定气体"。1774年,德国化学家伯格曼将石蕊溶液滴到溶有CO 2的水中,石蕊溶液由紫色变成微红色。当时已经发现石蕊溶液是一种酸碱指示剂。卡文迪许和伯格曼两位化学家的实验说明CO 2不仅能溶于水,还可与水反应。CO 2与水反应的化学方程式为 。
如图装置常用于实验室制取气体,请回答问题。
(1)仪器a的名称是 。
(2)实验室用氯酸钾和二氧化锰混合制取并收集干燥的氧气,应该选择的发生装置和收集装置是 (填字母),反应的化学方程式为 。
(3)实验室用B装置制取CO2,并用F装置检验CO2,试管中所盛放的溶液为 。
实验是化学研究的基础,结合下列实验装置及图示回答问题。
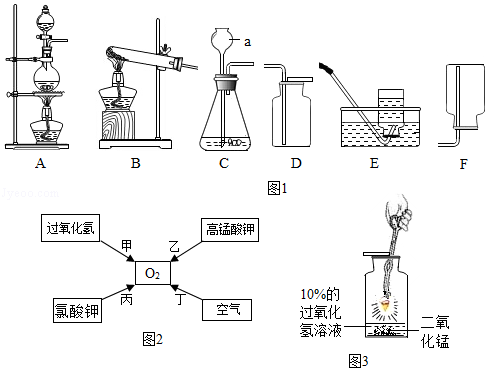
(1)图中a的仪器名称是 。
(2)"绿色化学"要求利用化学原理从源头上消除污染,实验室制取氧气的方法中最能体现绿色化追求的途径是 (填编号),该反应的化学方程式是 。
(3)若用二氧化锰和双氧水混合加热制备氧气,应选择的发生装置和收集装置的组合是 (填字母编号)。
(4)做铁丝在氧气中燃烧的实验改进如图3所示,其优点是实验简便、保证安全和 。
化学是一门以实验为基础的自然科学,化学实验和科学探究离不开装置。
| 制取气体的常用装置 |
|
|
|
| 收集气体的常用装置 |
|
|
|
| 干燥气体的常用装置 |
|
|
此格空白 |
(1)制取气体时,首先要对发生装置进行气密性的检查,确保装置不漏气。检查装置C气密性的方法是:首先将导管的末端浸在水中,然后用双手紧握试管,一会儿发现导管末端 ,松开双手后,导管末端液面上升,形成一段稳定的水柱,说明装置的气密性良好。
(2)收集气体的方法主要决定于气体的性质。装置F所示的收集方法是 ,被收集气体的密度 空气的密度(填"大于"、"等于"或"小于");如果用D装置收集某种气体,发现 时,证明气体已集满。
(3)实验室用大理石和稀盐酸反应制取并收集一瓶干燥的二氧化碳气体,所选装置正确的连接顺序是 → → (填装置编号)。
(4)从安全、环保、节能、简便等方面考虑,实验室制取氧气的最佳方法就是利用过氧化氢在二氧化锰做催化剂的条件下分解,其主要操作步骤有:①检查装置的气密性;②组装仪器;③向漏斗中注入过氧化氢溶液;④向锥形瓶中放入二氧化锰;⑤收集气体。正确的操作顺序是 (填序号)。
a.①②③④⑤
b.①④②③⑤
c.②①④③⑤
d.②③④①⑤
(5)写出用高锰酸钾加热制取氧气的化学方程式 。
氢氧化亚铁是白色难溶于水的物质,若接触到空气迅速被氧化,转化成红褐色的氢氧化铁。化学反应方程式为:4Fe(OH) 2+O 2+2H 2O=4Fe(OH) 3,某化学兴趣小组利用实验室提供的药品:铁屑、稀硫酸、氢氧化钠溶液以及如图装置进行实验,观察到产生了白色的氢氧化亚铁沉淀。请回答下列问题:
(1)对于反应4Fe(OH) 2+O 2+2H 2O=4Fe(OH) 3,它的化学反应基本类型是 ,其中化合价升高的元素为 。(写元素名称)
(2)配制药品的蒸馏水需要加热煮沸,解释原因 。
(3)实验得到氢氧化亚铁涉及到的化学方程式有:
①Fe+H 2SO 4═FeSO 4+H 2↑
② 。(写出化学方程式)
(4)试管Ⅰ中加入的药品为 ,试管Ⅱ中加入的药品为 。(均写名称)
(5)请将缺少的实验步骤补全:如图连接好仪器→检查装置气密性→装入药品迅速塞紧塞子→打开止水夹→ ,很快观察到白色沉淀在 试管中产生(填"Ⅰ"或"Ⅱ")。
初中化学中,我们学习了酸和碱发生中和反应的实质是H ++OH ﹣═H 2O.如图,像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。离子方程式的书写一般按以下步骤:(以Na 2SO 4与BaCl 2反应为例)
①写出Na 2SO 4与BaCl 2反应的化学方程式: ;
②把易溶于水、易电解的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成:2Na ++SO 4 2﹣+Ba 2++2Cl ﹣═BaSO 4↓+2Na ++2Cl ﹣
③删去方程式两边不参加反应的离子:Ba 2++SO 4 2﹣═BaSO 4↓
④检查方程式两边各元素的原子个数和电荷总数是否相等。
请回答:
(1)下列各组中的离子,在pH=3的水溶液中能大量共存的是
A、Na +、Mg 2+、Cl ﹣、SO 4 2﹣ B、Na +、K +、Cl ﹣、OH ﹣
C、Na +、Cu 2+、Cl ﹣、SO 4 2﹣ D、Na +、K +、Cl ﹣、CO 3 2﹣
(2)写出稀盐酸滴在石灰石上所发生反应的离子方程式 ;
(3)写出一个与离子方程式Mg+2H +═Mg 2++H 2↑相对应的化学方程式 ;
(4)酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离子的反应,只要具备生成物中有气体或沉淀或 生成,反应就能发生。

氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
I.制氢:铁酸锌(ZnFe 2O 4)可用于循环分解水制氢,其反应可表示为:
6ZnFe 2O 4 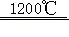 6ZnO+4Fe 3O 4+O 2↑;3ZnO+2Fe 3O 4+H 2O
6ZnO+4Fe 3O 4+O 2↑;3ZnO+2Fe 3O 4+H 2O 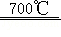 3ZnFe 2O 4+H 2↑
3ZnFe 2O 4+H 2↑
(1)ZnFe 2O 4中Fe的化合价为 。
(2)该循环制氢中不断消耗的物质是 (填化学式),得到H 2和O 2的质量比为 。
(3)氢气作为新能源的优点有 (任写一点)。该循环法制氢的不足之处是 。
Ⅱ.贮氢:合金Mg 2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg 2Cu+3H 2 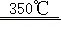 3MgH 2+MgCu 2
3MgH 2+MgCu 2
(4)熔炼制备Mg 2Cu合金时,通入氩气的目的是 。
(5)氢化物MgH 2与水反应生成一种碱,并释放出H 2. 其化学反应方程式为 。
(6)11.2g Mg 2Cu完全吸氢后所得混合物与过量盐酸反应,放出H 2的质量为 g。