某纯碱厂生产的某批次碳酸钠产品中可能含有氯化钠杂质。
定性检验
(1))要确定该产品中是否含有杂质氯化钠,你的方法是 。
定量测定
(2)若利用沉淀法测定该产品中碳酸钠的质量分数,你确定的反应原理是(用化学方程式表示) 。
(3)假设你取样的质量为m 1,根据你确定的反应原理,你需要通过实验测量沉淀(填化学式) 的质量(假设你测得的沉淀的质量为m 2)。
(4)请你设计实验方案,获得数据m 1、m 2,把方案填在下表中。
| 适用的仪器名称 |
实验步骤 |
| |
|
(5)数据处理:
请用含m 1、m 2的式子表示所测样品中碳酸钠的质量分数。 。
分析讨论
(6)要测定混合物中某成分的含量,可通过化学方法将不易测定的物质转化为易测量的物质。除沉淀法外,还可依据反应(用化学方程式表示) 来测定该纯碱样品中碳酸钠的质量分数。
燃料作为重要的能源对人类社会的发展起到至关重要的作用。
(1)目前人们使用的燃料大多来自煤、 、天然气等化石燃料。
(2)化石燃料造福人类的同时,也对环境造成了不良影响,如煤燃烧时排放出的 (填一种即可)等污染物会导致酸雨;煤不充分燃烧产生CO等污染物,为使煤充分燃烧通常考虑 (答一点即可)。
(3)氢气作为能源因其具有 (答一点即可)等优点,越来越受人们的关注。
电解水可以制取氢气,该反应的化学方程式为 。
化学就在我们身边,它能改善我们的生活。请回答下列问题:
(1)人体中化学元素含量的多少直接影响人体的健康,缺少 (填元素符号)元素有可能导致骨质疏松、畸形,易得佝偻病。
(2)用洗洁精洗去餐具上的油污,这是利用了洗洁精的 作用。
(3)葡萄糖(化学式为C 6H 12O 6)是一种重要的营养物质。葡萄糖由 种元素组成,一个葡萄糖分子中有 个原子,其中氢、氧元素质量比为 。
(4)目前,人类使用的燃料大多来自化石燃料。燃烧含硫化石燃料会产生二氧化硫,请写出硫在空气中燃烧的化学方程式 。大量二氧化硫释放到空气中会导致雨水的pH (填"大于"或"小于")5.6,形成酸雨。
写出下列反应的化学方程式,并注明反应的基本类型。
(1)高温煅烧石灰石: ; 。
(2)镁条在氧气中燃烧: ; 。
(3)铁与硫酸铜溶液反应: ;
“水循环”、“氧循环”和“碳循环”是自然界存在的三大重要循环。请结合如图1回答问题:

(1)从物质变化及分子角度看,三种循环中有一种与另外两种在变化上有本质的区别这种循环主要是由
的运动引起的;
(2)用学科观点分析碳循环和氧循环,其中正确的是 (填字母序号);
A.变化观:每个人都在参与碳、氧循环
B.守恒观:碳、氧循环过程中各元素守恒,其化合价不变
C.平衡观:碳、氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定
D.微粒观:绿色植物的作用是使自然界中的氧原子总数增加
(3)自然界中的碳循环主要是通过二氧化碳来实现的。图1中消耗二氧化碳的途径有 (填数字序号)。近年来,大气中二氧化碳含量增加,导致温室效应,因此人类要积极采取措施维持循环体系中二氧化碳的相对平衡;
(4)为解决日益加剧的温室效应,有科学家提出“绿色自由”构想:把CO2含量高的气体用氢氧化钠溶液吸收,然后再通化学反应在分解池内放出二氧化碳进入合成塔,在合成塔内300℃、200kPa和催化剂条件下使之变为甲醇(CH3OH)和水。写出该反应的化学方程式 。
(1)如图1为实验室制取并收集气体的装置图,请回答下列问题。
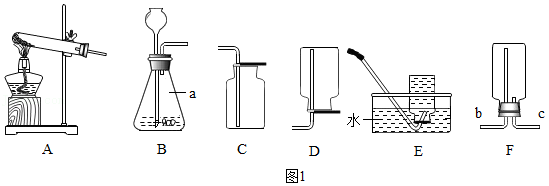
①仪器a的名称是 。
②若用A装置制取氧气,写出对应的化学方程式 。
③若需收集一瓶较纯净的氧气,应选用的装置是 (填装置序号)。
④若用C装置收集一瓶二氧化碳气体,其验满的方法是 。
⑤二氧化硫是一种有刺激性气味的有毒气体,比空气的密度大,易溶于水且与水反应。若用F装置收集二氧化硫气体,则气体应从 (填“b”或“c”)端导入。
(2)电解饱和食盐水可以制得氢氧化钠、氯气(Cl2)和氢气,并进而生产具有消毒、漂白作用的漂白液。
①粗盐中的难溶性杂质可通过溶解、 操作除去,以免破坏电解装置。
②写出电解饱和食盐水的化学方程式 。
③某同学想知道某一瓶放置一段时间的漂白液是否变质,设计了下列探究实验。
【查阅资料】
Ⅰ.制取漂白液(有效成分为NaClO)的原理:Cl2+2NaOH═NaCl+NaClO+H2O;
Ⅱ.在空气中NaClO易发生反应:2NaClO+H2O+CO2═Na2CO3+2HClO,HClO能使有色布条褪色,且HClO含量越高,漂白效果越好;HClO易分解,分解后丧失漂白作用;
Ⅲ.Ca(ClO)2易溶于水。
【提出问题】放置一段时间的漂白液是否变质?
【提出猜想】
猜想1:未变质,溶液中主要成分为NaCl、NaClO
猜想2:部分变质,溶液中主要成分为NaCl、NaClO、Na2CO3
猜想3:全部变质,溶液中主要成分为NaCl、Na2CO3
【实验探究】
实验操作 |
实验现象 |
实验结论 |
ⅰ取适量该溶液于烧杯中,放入有色布条 |
|
猜想3不成立 |
ⅱ另取适量该溶液于试管中,滴入适量氯化钙溶液 |
产生白色沉淀 |
猜想 成立 |
写出实验操作ii中产生白色沉淀的化学方程式 。
【拓展应用】由【查阅资料】和图2可知,需控制pH约为 时(填整数),漂白液具有最佳漂白能力。

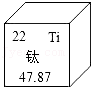
金属材料与人类生活息息相关,请回答下列问题。
(1)钛元素在元素周期表中的信息如图所示,则钛的相对原子质量是 。
(2)家用台灯通常采用铜质插头,是利用金属铜的 性。
(3)我国是最早采用湿法炼铜的国家,铁与硫酸铜溶液反应的化学方程式是 。
(4)将一定质量的Zn片加入AgNO3、Cu(NO3)2的混合溶液中,充分反应后过滤,得到滤渣和滤液,则滤渣中一定含有的金属是 ;若滤液蓝色,则滤液中溶质一定有 。
我国“十四五”规划已经明确“2030年前实现碳达峰”的目标。碳达峰是指二氧化碳的排放达到峰值,不再增长。如图为自然界中CO2的循环图,图中箭头指向表示产生(排放)或消耗CO2的途径。回答下列问题:
(1)途径①需要消耗空气中的 。
(2)途径②中,枯枝败叶中的纤维素[化学式为(C6H10O5)n]在微生物作用下彻底转化为CO2和H2O,该转化中消耗O2与产生的CO2分子个数比为 。
(3)途径④通过光合作用吸收CO2的量白天 夜晚(填“大于”或“小于”)。

(4)途径⑤消耗的化石燃料是 (填“可”或“不可”)再生资源。
(5)降碳的一种途径是在合适的催化剂条件下,将二氧化碳与氢气反应使碳全部转化为乙烯(C2H4)、同时生成另一种化合物。请写出反应的化学方程式 。
(6)某年通过不同途径产生或消耗碳量的相对值如下表所示:
途径 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
相对值 |
0.6 |
60 |
60 |
121.8 |
5.5 |
92 |
90 |
据表可知,这一年大气中碳量增加了 (用表中相对值计算)。为达成“2030年前实现碳达峰”的目标,下列措施不可行的是 。
A.开发新能源
B.植树造林
C.禁止使用化石燃料
进一步分析上表回答:人口增多是否是大气中碳量增加的主要因素,并说明理由 。
2021年3月,四川“三星堆遗址”已出土黄金面具、青铜艺术品、象牙、残存的丝织品等重要文物,其中青铜为合金。
(1)下列物质中属于金属材料的有 (填序号)。
A.象牙
B.黄金
C.丝织品
D.青铜
(2)青铜的硬度比纯铜 (填“大”或“小”)。
(3)铜制品长期暴露在空气中能与空气中的O2、H2O和 化合生成铜锈【主要成分是Cu(OH)2CO3】。
(4)黄铜是铜锌合金,区分黄铜和纯铜发生反应的化学方程式为 。
含有镁的合金广泛应用于航空航天领域,回答下列问题:
(1)取少量光亮的镁条于试管中,向其中加入稀盐酸,观察到 的现象可推断二者发生了化学反应。
(2)若验证镁与稀盐酸反应后的溶液中有盐酸剩余,下列实验设计可行的是 。
A.取生锈的铁钉于试管中,加入反应后的溶液
B.取少量反应后的溶液于试管中,滴加AgNO3溶液
C.取少量反应后的溶液于试管中,滴加稀氢氧化钠溶液
(3)向镁条中加入过量稀盐酸,完全反应后,再加入过量氢氧化钠溶液,生成5.8g氢氧化镁沉淀。
①写出加入氢氧化钠溶液时,生成氢氧化镁沉淀的化学方程式 ;
②计算镁条与稀盐酸完全反应后生成MgCl2的质量为 g。
新型冠状病毒肺炎疫情防控期间,要合理搭配饮食,以保证基本营养素的均衡摄取,增强身体免疫力;要合理使用消毒剂进行杀菌消毒。请回答下列问题:
(1)下列物质富含蛋白质的是 (填写字母标号)。
| A. |
水果、蔬菜 |
| B. |
花生油、奶油 |
| C. |
纯牛奶、蛋清 |
| D. |
米饭、馒头 |
(2)下列物质常用于制作消毒剂,其中属于氧化物的是 (填写字母标号)。
| A. |
过氧乙酸(CH 3COOOH) |
| B. |
二氧化氯(ClO 2) |
| C. |
苯酚(C 6H 6O) |
| D. |
次氯酸钙[Ca(ClO) 2] |
(3)体积分数为75%的酒精常用于手和皮肤消毒。因易燃,使用时要注意远离火源。乙醇燃烧的化学方程式是 。
(4)"84"消毒液的有效成分是次氯酸钠(NaClO),适用于物体表面以及室内环境等方面的消毒。NaClO中氯元素的化合价是 。
下列化学方程式及对应的基本反应类型都正确的是( )
A.CaHCO3═CaCO3↓+CO2↑+H2O 分解反应
B.Al(OH)3+3HCl═AlCl3+3H2O 复分解反应
C.P+O2 P2O5 化合反应
D.Fe2O3+3CO 3CO2+2Fe 置换反应
化学是一门以实验为基础的学科。请结合下列实验装置图回答问题:

(1)写出图中①、②两种仪器的名称:① ,② 。
(2)某同学用高锰酸钾加热制取氧气,反应的化学方程式为 ;应选择的发生装置为 (填字母) ,收集装置为 (填字母)。
(3)A装置与C装置比较,A装置的优点是可以控制反应的发生和停止。请写出一个利用A装置此优点的反应化学方程式 。
(4)实验室可用金属与浓硫酸反应制取SO2气体,金属锌和金属铜都能与浓硫酸反应制SO2气体。欲制取一瓶纯净的SO2气体,最好选择金属 (填“锌”或“铜”),选择理由是 。
壮丽七十年,奋斗新时代。我国科技发展日新月异,在空间科学研究领域取得重大成果。

①2019年1月3日,“嫦娥”四号成功实现人类探测器首次月球背面软着陆,开启了人类月球探测新篇章。“嫦娥”四号探测器由“长征”三号乙改进型运载火箭携带升空,该运载火箭的推进剂中有液氢和液氧。试写出氢气在氧气中燃烧的化学方程式: 。
②我国“墨子号”量子科学实验卫星团队在量子通信实验方面做出了卓越贡献,”墨子号”量子科学实验卫星上的光伏太阳能电池板的基板材料是玻璃纤维,光伏太阳能电池的作用是将 能转化为电能。在玻璃纤维中含有多种成分,其中有Na2SiO3、CaSiO3、SiO2,在上述三种物质中,硅元素表现的化合价均为 价。