水是生命之源,是人类宝贵的自然资源。
Ⅰ.节约用水
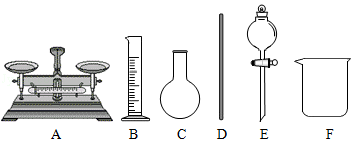
(1)如图所示图标是我国“国家节水标志”的是 (填字母)。

Ⅱ.水的净化
天然水净化为自来水的主要流程如图所示:

(2)“沉降池”中可用明矾作混凝剂,其化学式为KAl(SO4)n•12H2O,n的值为 。
(3)“吸附池”中常用 (填物质名称)吸附色素和异味。
(4)“消毒池”中常用液氯作消毒剂,发生了反应:Cl2+H2O═HCl+HClO。若用自来水直接配制硝酸银溶液会产生氯化银白色沉淀。写出盐酸与硝酸银溶液反应的化学方程式: 。
Ⅲ.废水处理
(5)废水中氨氮(以NH3形式存在)含量过高,直接排放会导致水体富营养化。次氯酸(HClO)可除去废水中的NH3,发生的反应为:2NH3+3HClO═X+3HCl+3H2O。X的化学式为 。若废水碱性过强(pH>10),NH3的去除率会显著降低,原因是 。
(1)"84消毒液"是现在家庭中常用的消毒剂和漂白剂(能使酸碱指示剂等有机色素褪色的物质),它的有效成分是NaClO."84消毒液"属于 (填"纯净物"或"混合物"),该消毒液呈碱性,我们 (填"能"或"不能")用pH试纸来测此溶液的pH,原因是 。(若"能"此空可不填)
(2)"84消毒液"制取原理为:Cl 2+2NaOH=NaClO+X+H 2O,则X的化学式为 。观察上述反应中物质及化合价变化的特点,硫与氢氧化钠溶液在加热条件下的反应与此类似,请填出空白处的物质的化学式:S+NaOH  Na 2SO 3+ +H 2O(未配平)
Na 2SO 3+ +H 2O(未配平)
(3)若配制"84消毒液"需要100g质量分数为a%的NaOH溶液,实验室配制该NaOH溶液,需要用到图中的玻璃仪器为 (填字母编号)。在配制过程量取水时,若仰视读数,会导致所配溶液溶质质量分数 (填"偏大"、"偏小"或"不变")。
在密闭容器中,某反应在点燃的条件下发生,涉及甲、乙、丙和丁四种物质,它们的微观示意图和反应前后的质量如表所示
| 物质序号 |
甲 |
乙 |
丙 |
丁 |
|
| 微观示意图 |
|
|
|
|
|
| 反应前质量/g |
34 |
50 |
1 |
0 |
|
| 反应后质量/g |
0 |
x |
y |
z |
(1)甲的化学式为 .
(2)表中的四种物质中,含氧元素的化合物是 (填物质序号).
(3)上述反应的化学方程式为 .
(4)一位同学在计算x,y和z数值的过程中,列出了以下等式,其中正确的是 (填字母序号)
| A. |
x+y+z=86 |
| B. |
y+z=85 |
| C. |
(50﹣x):z=32:64 |
| D. |
(50﹣x):(y﹣1)8:3. |
尿素[CO(NH 2) 2]在工农业生产中应用广泛。
(1)尿素溶液能除去工业废气Cl 2.化学方程式为:CO(NH 2) 2+H 2O+3Cl 2=N 2+CO 2+6X,则X的化学式是 。
(2)尿素是目前使用量较大的一种 (选填"氮"、"磷"或"钾")肥,适用于各种植物,某水田施加7.2千克尿素,其中含氮元素多少千克?
碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究。
【猜想】Mg(OH)Cl分解后产物可能有:Mg、MgCl 2、MgO、HCl气体、H 2O、Cl 2。
【实验一】取少量的Mg(OH)Cl放入大试管中,按如图所示装置进行实验,加热过程中观察到足量硝酸银溶液中有白色沉淀产生,一段时间后,沉淀不再产生,大试管口也没有液滴形成,管内有固体剩余,无其他现象。由此推知Mg(OH)Cl分解后产物中有 气体,无其他气体。
【实验二】取少量实验一的剩余固体于试管中,加入足量稀盐酸,没有气泡产生,由此推知Mg(OH)Cl分解后产物中没有 。
【实验三】再取少量实验一的剩余固体,加入足量稀硝酸,固体全部溶解,再滴入AgNO 3溶液,无沉淀产生,由此推知Mg(OH)Cl分解后产物中没有 。
【结论】Mg(OH)Cl受热分解的化学反应方程式为 。

化学实验是进行科学探究的重要于段,根据实验回答下列问题
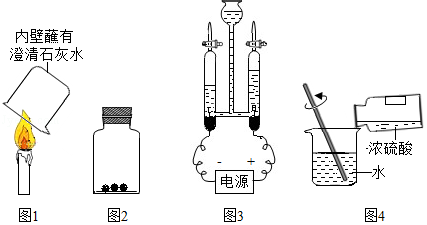
(1)图1实验观察到澄清的石灰水变浑浊,证明石蜡的成分中一定含有 元素,依据的原理是 。
(2)图2实验,向盛有红棕色二氧化氮气体的集气瓶里投入几小块烘烤过的木炭,红棕色会消失,这是由于木炭具有 性。
(3)图3是电解水实验,切断电源后,用 分别在两个玻璃管尖嘴口检验电解反应中产生的气体。
(4)图4是稀释浓硫酸的正确操作,如果将水注入浓硫酸,后果是 ,如果不慎将浓硫酸沾到皮肤上,应立即用 ,再涂上3%﹣5%的碳酸氢钠溶液。
请根据如图实验回答问题.

(1)图①中先燃烧的物质是 .
(2)配制一定溶质质量分数的溶液,按图②所示量取水的体积,当其他操作均正确,所配溶液的溶质质量分数会 (填"偏大"、"偏小"或''无影响).
(3)图③中干而冷的烧杯内壁上有水雾产生,说明石蜡中含有 元素.
(4)图④是测定空气中氧气含量的改进装置(利用电热丝通电放出热量引燃红磷),其优点是 .