下列图象关系合理的是( )
| A.在部分变质的NaOH溶液中加入稀硫酸 |
| B.在饱和的KNO3溶液中加入KNO3晶体 |
| C.向pH=9的KOH溶液中不断加水 |
| D.分别将等质量的Fe和Mg加入两份质量相同浓度相同的稀盐酸中 |
类推是学习中常用的思维方法,现有以下类推结果,其中错误的是
①碱的水溶液通常呈碱性,所以碱性溶液一定是碱的溶液
②氧化物都含有氧元素,所以含氧元素的化合物不一定是氧化物
③酸碱发生中和反应生成盐和水,所以生成水的反应一定是中和反应
④燃烧一般都伴随发光、发热现象,所以有发光、发热现象的变化就是燃烧
⑤单质是由同种元素组成的,则由同种元素组成的纯净物一定是单质
| A.①②③④ | B.①②③④⑤ | C.②③④⑤ | D.①③④ |
向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )
| |
烧杯中的物质 |
x溶液 |
| A |
稀盐酸和硫酸铜 |
烧碱 |
| B |
稀硫酸和稀盐酸 |
氯化钡 |
| C |
镁铝合金 |
稀盐酸 |
| D |
生锈铁钉 |
稀盐酸 |

A.A B. B C. C D. D
除去下列物质中的杂质,所选用的试剂及操作方法不正确的是( )
| |
物质 |
所含杂质 |
除去杂质的方法 |
| A |
二氧化碳 |
一氧化碳 |
点燃 |
| B |
硫酸亚铁溶液 |
硫酸铜 |
加入足量的铁粉,过滤 |
| C |
氮气 |
氧气 |
将气体缓缓通过灼热的铜网 |
| D |
氯化钙溶液 |
稀盐酸 |
过量碳酸钙,过滤 |
除去下列物质中混有的少量杂质,所选用的试剂及操作方法不正确的是
| 序号 |
物质 |
杂质(少量) |
试剂和操作方法 |
| A |
O2 |
H2O |
通过浓H2SO4,洗气 |
| B |
稀盐酸 |
稀硫酸 |
加入过量BaCl2溶液,过滤 |
| C |
CaO粉末 |
CaCO3粉末 |
高温煅烧 |
| D |
NaOH溶液 |
Na2CO3溶液 |
加入适量的CaCl2溶液,过滤 |
现有A~F六种常见物质,其中B是食品包装中的常用的干燥剂,C是常用建筑材料的主要成份,A、B、C三种白色固体都含有同种金属元素,E是黑色固体单质,D、F是气体且含有相同的组成元素,它们的转化关系如下图。请回答:
(1)固态D的俗称: 。
(2)写出下列变化的化学方程式:
E → F : ;属于 反应(填基本反应类型)。
B → A : ;此反应 (填“放热”或“吸热”)。
以下归纳和总结完全正确的是
| A. 对日常生活经验的认识 |
B.对防锈的认识 |
| ①用碘酒检验某火腿肠中是否含有淀粉 ②鉴别棉纤维和羊毛纤维,点燃后闻气味 ③进入久未开启的菜窖,先做灯火实验 |
①“辽宁”号航母舰体外壳涂油漆防锈 ②保留铁锈可防止铁进一步锈蚀 ③可用稀硫酸除去铁锈 |
| C. 对原理或现象的认识 |
D.对安全的认识 |
| ①在HCl和CaCl2混合溶液中逐滴加入碳酸钾溶液,先有气泡后产生白色沉淀 ②硝酸铵与熟石灰混合产生氨臭气味 ③浓盐酸应密封保存,是因为它易挥发 |
①点燃可燃性气体前一定要验纯 ②凡能产生有毒气体的实验均不要进行 ③海鲜食品喷洒甲醛溶液防腐 |
除去下列物质中含有的杂质(括号内为杂质),所选试剂或方法不正确的是
| A.CO2(CO)——O2/△ | B.N2(O2)——Cu/△ |
| C.CO2(H2O)——浓H2SO4 | D.NaCl(Na2CO3)——稀盐酸 |
下列各组物质在给定条件下能大量共存的是
| A.在pH=l的溶液中:NaCl、Na2CO3、Na2SO4 |
| B.在pH=2的溶液中:KCl、Na2SO4、HNO3 |
| C.在pH=13的溶液中:CaCl2、Na2CO3、NaOH |
| D.在pH=14的溶液中:FeCl3、Ba(NO3)2、CaCl2 |
下列各组变化中,每一个转化在一定条件下均能一步实现的是
| A.①和② | B.②和③ | C.①和③ | D.①②⑧ |
除去下列物质中的少量杂质(括号内是杂质),所用试剂及方法均正确的是
| A.铜粉(碳粉)——在空气中灼烧 |
| B.氯化亚铁溶液(氯化铜)——加过量的锌粉、过滤 |
| C.氢氧化钠(碳酸钠)——加适量的稀盐酸、蒸发 |
| D.一氧化碳(二氧化碳)——通过足量的氢氧化钠溶液、干燥 |
某同学在做中和反应实验时,向盛有氢氧化钠溶液的烧杯中直接滴加了稀盐酸,忘记滴加指示剂酚酞.为确定稀盐酸和氢氧化钠溶液是否恰好完全反应,该同学设计了如下实验:
(1)从烧杯中取出少量反应后的溶液于试管中,向其中滴加酚酞试液,振荡,观察到酚酞试液不变色此现象能否证明稀盐酸和氢氧化钠溶液恰好完全反应?原因是什么?
(2)我们可以改为加入什么试剂来判断是否完全反应?
某化学课堂围绕,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式 。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是 。
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 |
测溶液pH |
滴加Na2CO3溶液 |
滴加BaCl2溶液 |
| 实验操作 |
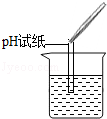 |
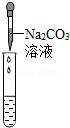 |
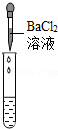 |
| 实验现象 |
试纸变色,对比比色卡,pH<7 |
。 |
产生白色沉淀 |
| 实验结论 |
溶液中有H2SO4 |
溶液中有H2SO4 |
溶液中有H2SO4 |
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究】(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是 。
(2)实验方案中也有一个是错误的,错误的原因是 。
氢氧化钴[Co(OH)2]能与酸性溶液反应,可作涂料和清漆的干燥剂。制备方法:
①Co+2HCl═CoCl2+H2↑ ②CoCl2+2NaOH═Co(OH)2↓+2NaCl.下列判断错误的是( )
| A.①为置换反应 | B.钴的金属活动性比铜强 |
| C.②为复分解反应 | D.Co(OH)2可以干燥氯化氢气体 |