胃酸过多须服用抗酸药。下表为两种抗酸药的有效成分及其构成微粒:
| 抗胃酸药 |
复方氢氧化镁片 |
铝碳酸镁片 |
| 有效成分 |
Mg(OH)2 |
AlMg(OH)3CO3 |
| 构成微粒 |
Mg2+、OH- |
Al3+、Mg2+、OH-、CO32- |
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异。
(1)Mg(OH)2起抗酸作用的微粒是 (填微粒符号,下同)。
(2)铝碳酸镁与盐酸反应生成两种盐和另外两种常见化合物。请写出相关化学方程式 。
下列四个图象中,能正确表示对应变化关系的是()
| A. |
向一定量稀盐酸中加水稀释 |
B. |
一定温度下,不饱和氯化钠溶液中加入氯化钠 |
C. |
室温时,向一定量的稀盐酸中加入少量镁条 |
D. |
用等质量、等浓度的双氧水分别制取氧气 |
氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的化学方程式为 ;
(2)加入H2O2氧化时,发生反应的化学方程式为(已经配平,X属于常见的化合物): ,则X的化学式为 ;
,则X的化学式为 ;
(3)NH3·H2O是氨水的主要成分,溶液显 性,加入氨水时,溶液的PH值 (填“增大”、“减少”或“不变”),当PH≈4时,会产生红褐色沉淀,则滤渣2 的成分是 (填化学式)。
(4)通常用PH试纸测定溶液的PH值,其操作方法是 。
(5)煅烧过程存在以下反应:木炭和硫酸镁在高温下除得到氧化镁外,还得两种气体,一种会造成酸雨,另一种大量排放则会引起温室效应。请写出该反应的化学方程式: 。
下列各种物质间的转换通过一步反应不能实现的是( )
| A.H2SO4→H2O | B.Cu→Cu(OH)2 |
| C.Fe→FeCl2 | D.CO2→CO |
下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是
| 序号 |
实验目的 |
实验过程 |
| ① |
证明变质 |
取少量溶液,滴加盐酸,将生成的气体通入石灰水 |
| ② |
确定成分 |
取少量溶液,加入石灰水,过滤,向滤液中滴加酚酞溶液 |
| ③ |
测定纯度 |
取一定量溶液,加入盐酸,用氢氧化钠固体吸收气体,称量 |
| ④ |
除去杂质 |
取溶液,滴加石灰水至恰好完全反应,过滤 |
A.②③ B.①③ C.②④ D.①④
(15分)兴趣小组分析了用硫铁矿烧渣(主要成份Fe203、Fe304、FeO等)制备铁红(Fe2O3) 的流程图并进行了铁红性质实验。
一、铁红制备的流程图分析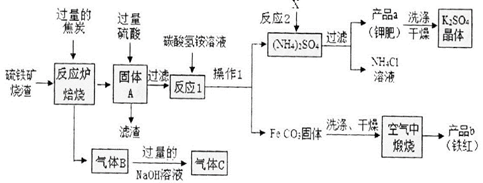
(1)写出焙烧中CO与Fe203反应的化学方程式_ 。
(2)实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒 和_ (填仪器名称)
(3)你认为对气体C最佳的处理方法 是_ 。
A.冷却后排入空气 B.燃烧后排放 C.再通入反应炉
(4)反应1的反应温度一般需控制在35℃以下,其目的是_ 。
(5)反应2中相关物质的溶解度如下表。你认为该反应在常温下能实现的原因是 。
洗涤干燥得到K2S04晶体时,可选用下列__ (填字母)洗涤剂;
A.KCl的饱和溶液 B.水 C.K2S04的饱和溶液
为检验K2S04晶体是否洗涤干净,可取最后一次洗涤液,先加入_ (选填序号,下同),
振荡、静置,再向上层清液中滴加_ ,观察现象即可判断。
A.AgN03溶液 B.过量的BaCl2溶液 C.过量的Ba(N03)2溶液
二、铁红的性质实验
【问题讨论】
【资料1】草酸晶体(H2C204·3H20)在浓H2S04作用下受热分解,化学方程式为:
H2C2O4·3H2O C02↑+C0↑+4H20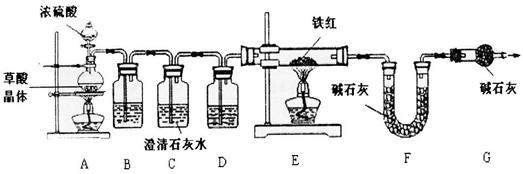
(6)实验前应先_ 。
(7)进入E中的气体是纯净、干燥的CO,则B、D中的试剂依次是__ 、___ (填字母编号)。
A.浓硫酸 B.澄清的石灰水 C.氢氧化钠溶液
(8)C装置的作用是 。
【数据分析与计算】
用SDTQ600热分析仪对氧化铁(Fe2O3)和CO进行热反应分析,获得相关数据,绘制成管内剩余固体质量〜反应温度的关系如下图。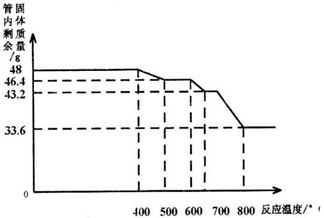
【资料2】已知铁的氧化物有:FeO、Fe304、Fe2O3,在一定的条件下,均能够逐步失去其中的氧,最终被还原为铁。
(9)800℃以上时,管内固体成分的化学式为 ;
(10)写出管内固体质量由48g变为46.4g时反应的化学方程式_ 。
【实验评价】
请指出【问题讨论】中实验装置的一个明显缺陷 。
向部分变质的氢氧化钠溶液中滴加过量稀盐酸,下列图像能正确反映对应变化关系的是
| A. |
|
B. |
|
C. |
|
D. |
|
在一定质量的甲溶液中逐渐加入乙至过量,反应过程中溶液的总质量与加入乙的质量关系,能用下图曲线表示的是
| 序号 |
甲 |
乙 |
| ① |
H2SO4溶液 |
NaOH溶液 |
| ② |
HCl溶液 |
大理石 |
| ③ |
BaCl2溶液 |
Na2SO4溶液 |
| ④ |
H2SO4溶液 |
锌粒 |
A.①② B.②④ C.②③④ D.①②④
下列有关化学反应类型的判断,不正确的是
A.CO2+C  2CO化合反应 2CO化合反应 |
B.CaCO3 CaO+CO2↑分解反应 CaO+CO2↑分解反应 |
C.CO+CuO Cu+CO2置换反应 Cu+CO2置换反应 |
| D.Ba(OH)2+2HClBaCl2+2H2O复分解反应 |
化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
【提出问题1】该氢氧化钠溶液是否变质了呢?
【实验探究1】
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,向溶液中滴加 , 并不断振荡. |
有 产生. |
氢氧化钠溶液一定变质了. |
【提出问题2】该氢氧化钠溶液是全部变质还是部分变质呢?
【猜想与假设】
猜想1:氢氧化钠溶液部分变质.
猜想2:氢氧化钠溶液全部变质.
【查阅资料】
(1)氯化钙溶液呈中性.
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
【实验探究2】
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的 溶液,并不断振荡. |
有 生成. |
说明原溶液中一定有碳酸钠. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. |
溶液变红色. |
说明原溶液中一定有 . |
【实验结论】该氢氧化钠溶液 (填“部分”或“全部”)变质.
【反思与评价】
(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式: .
(2)在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案 (填“可行”或“不可行”).
某化工厂排出的废水透明、澄清、略显蓝色。一同学取少量废水,加入过量的盐酸,有不溶于稀HNO3的白色沉淀生成。过滤,将所得滤液分成两份,一份滤液中加入少量稀H2SO4,也有不溶于稀HNO3的白色沉淀生成;另一份滤液中加入过量NaOH溶液,产生蓝色沉淀。试回答:
(1)用化学式回答:废水中加入过量的盐酸后,生成的白色沉淀是________________。
滤液中加入过量NaOH溶液后,生成的蓝色沉淀是_________________________。
(2)废水中一定含有的物质是__________________(填编号):
| A.氯化物 | B.硝酸盐 | C.硫酸盐 | D.碳酸盐 |
请简述你做出选择的理由__________________________________。
"类推"是学习化学的常用方法,下列推理正确的是()
| A. | 酸和碱生成盐和水的反应属于中和反应,故盐酸和氢氧化钠溶液能发生中和反应 |
| B. | 酸的溶液pH<7,故pH<7的溶液一定是酸的溶液 |
| C. | 镁条在空气中燃烧生成白色固体,故铜片在空气中的灼烧也生成白色固体 |
| D. | 碳可用于炼铁,故碳可用于冶炼所有的金属 |
将0.4%的氢氧化钠溶液滴加到2
0.4%的盐酸中,测得混合液的
变化曲线如图。某学习小组对加入0-
氢氧化钠过程中,所得混合液
增大原因进行了如下探究:

【猜想假设】
猜想Ⅰ:
增大是因为;
猜想Ⅱ:
增大是因为发生了反应,写出反应方程式。
【实验探究】
为验证猜想Ⅱ,请你帮助该小组完成下列实验。(可供选择的实验用品有:
计、0.4%的氢氧化钠溶液、0.4%的盐酸、水。)
(1)向2
0.4%的盐酸中加入
0.4%的氢氧化钠溶液,用pH计测得混合液的
=7。
(2)向2
0.4%的盐酸中加入
,用pH计测得混合液的
7(填">"、"="或"<")。综合(1)和(2)证明猜想Ⅱ成立。
下列四个图像分别对应四个变化过程,其中正确的是
| A.一定量的饱和石灰水中加入氧化钙 |
| B.常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应 |
| C.等体积,等浓度的双氧水制取氧气 |
| D.服用胃舒平[主要成分Al(OH)3]治疗胃酸过多,胃液pH的变化 |