验证金属Fe Cu Ag的活动性强弱,下列方案不能达到目的是
| A.Fe CuSO4溶液 Ag |
| B.FeSO4溶液 Cu AgNO3溶液 |
| C.Fe Cu AgNO3溶液稀盐酸 |
| D.FeSO4溶液 Cu Ag |
如图所示,将一个塑料小球放入盛有硫酸铜溶液的烧杯中,小球漂浮于液面,将足量的铁粉投入到烧杯中,充分反应后,观察到铁粉表面有红色物质析出,写出有关反应的化学方程式 ;若溶液体积变化忽略不计,则塑料小球浸入液体中的体积跟原来相比 .

探究金属活动性顺序时,将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象.推测该气体可能是
| A.氢气 | B.二氧化硫 | C.二氧化碳 | D.一氧化碳 |
将X,Y,Z三种金属分别投入足量的稀硫酸中,只有X,Z能发生反应,并放出氢气.将Z投入X的硝酸盐溶液中,有金属X产生.则X,Y,Z三种金属的活动性由强到弱的顺序为
| A.Z>Y>X | B.Z>X>Y | C.X>Z>Y | D.Y>Z>X |
把一根洁净的铁钉放入稀硫酸中,下列叙述正确的是
①在铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色 ③铁钉的质量增加 ④溶液的质量减轻.
| A.②③ | B.①②③ | C.①②④ | D.①② |
现将X、Y两种金属片分别插入硫酸铜溶液中,X无明显变化,Y表面有铜析出,则X、Y、Cu三种金属的活动性由强到弱的顺序是
| A.X > Y > Cu | B.Cu > X > Y | C.Y > Cu > X | D.X > Cu > Y |
下列现象的描述正确的是
| A.磷在空气中燃烧,产生大量白色烟雾 |
| B.碳酸氢铵受热分解,生成白色固体 |
| C.铁在氧气中剧烈燃烧,火星四射,生成黑色固体四氧化三铁 |
| D.铁与稀硫酸反应有气泡产生,溶液由无色变成浅绿色 |
向CuO和铁粉的混合物中加入一定量的稀硫酸,微热,充分反应后冷却、过滤,在滤液中放入一枚洁净的铁钉,发现铁钉表面无任何变化。据此判断,下列结论正确的是
| A.滤液中一定含有FeSO4,可能含有H2SO4 |
| B.滤液中可能有CuSO4 |
| C.滤渣里一定有Cu,可能有Fe和CuO |
| D.滤渣里一定有Cu和Fe |
下列日常生活常见的金属中,金属活动性最强的是
| A.Fe | B.Cu | C.Al | D.Zn |
氯化铁溶液能与铜反应生成可溶性的氯化铜和氯化亚铁,工业上常用此原理生产印刷线路板。以下是印刷线路板的生产及废液的处理过程:
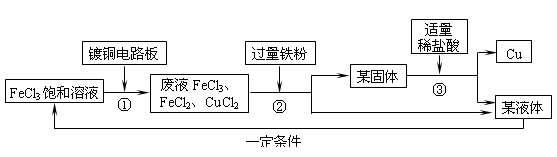
请回答下列问题:
(1)步骤②③中实验操作的名称是 。
步骤②实验操作前发生了两个反应:2FeCl3+Fe = 3FeCl2和 ,
(2)步骤③中适量稀盐酸的标志是 ;
发生反应的化学方程式是 。
(3)该流程中可以循环、回收利用的物质是 。
向一定量的AgNO3与Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤。分析判断下列说法正确的是
| A.滤渣中一定有Ag,可能有Zn和Cu |
| B.滤渣中一定有Cu、Ag,可能有Zn |
| C.滤液中只有Zn(NO3)2 |
| D.滤液中一定有Zn(NO3)2,可能有Cu(NO3)2和AgNO3 |
有甲、乙、丙、丁四种金属,仅甲在自然界中主要以单质的形式存在。丙盐的水溶液不能用丁制容器盛放,丁与乙盐的水溶液不反应。这四种金属的活动性由强到弱的顺序是
| A.甲>乙>丙>丁 | B.乙>丁>丙>甲 |
| C.丙>乙>甲>丁 | D.丁>乙>甲>丙 |
学习要善于归纳和总结。以下认识完全正确的是
| A.对除杂的认识 |
B.对环境保护的认识 |
| ①用稀硫酸除去Fe中混有的Zn ②用点燃的方法除去二氧化碳中的一氧化碳 |
①二氧化碳排放过多会导致温室效应 ②生活污水排放对水质影响不大 |
| C.对物质的鉴别 |
D.对化学史的认识 |
| ①硬水和软水:观察是否澄清 ②黄金和假黄金(铜锌合金) :滴加稀盐酸, 看是否有气泡产生 |
①门捷列夫发现了元素周期律 ②拉瓦锡提出了质量守恒定律 |
对物质的性质进行比较归纳,有利于更好的学习化学。下列对物质性质的归纳中,正确的是
A.H2、O2、CH4都具有可燃性
B.H2、C、CO都能和CuO发生置换反应
C.石墨、木炭、活性炭都具有吸附性
D.Fe、Al、Cu都能和AgNO3溶液发生置换反应