(5分)某化学兴趣小组的学生,发现金属R不在初中学到的金属活动性顺序表中,该小组为了了解R与常见金属铝、铜的金属活动性顺序,进行如下探究活动:
【作出猜想】他们考虑到铝的活动性比铜强,对三种金属的活动性顺序作出如下猜想:
猜想一:Al>Cu>R,猜想二: ,猜想三:R> Al>Cu,
【查阅资料】R是一种银白色的金属,在R的盐溶液中只有+2价R的盐溶液呈蓝色,常温下铝的表面会形成一层致密的氧化膜;硫酸铝、氯化铝、硝酸铝的溶液均为无色。
【实验探究】为了探究哪一种猜想成立,甲、乙、丙三位同学分别针对猜想一、猜想二、猜想三设计实验方案并展开实验探究。
| 猜想 |
主要操作 |
主要现象 |
实验结论 |
| 猜想一 |
打磨R丝,并将其插入到硫酸铜溶液中. |
R丝表面覆盖了一层红色的物质. |
猜想一 (填“成立”或“不成立”) |
| 猜想二 |
打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中. |
①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色. ②铝丝表面产生气泡较快. ③铜丝表面没有气泡产生. |
猜想二成立. |
| 猜想三 |
将打磨过的铝丝插入到 溶液中. |
无明显现象. |
猜想三成立 |
 【交流反思】究竟哪种猜想成立?三位同学经讨论交流,发现丙同学在实验前没有打磨铝丝,这可能会导致实验结论错误。于是他们先打磨铝丝,再将其插入到丙同学做实验用过的溶液中,一段时间后,溶液的颜色 ;进而确认猜想三不成立,猜想二成立。
【交流反思】究竟哪种猜想成立?三位同学经讨论交流,发现丙同学在实验前没有打磨铝丝,这可能会导致实验结论错误。于是他们先打磨铝丝,再将其插入到丙同学做实验用过的溶液中,一段时间后,溶液的颜色 ;进而确认猜想三不成立,猜想二成立。
【归纳总结】探究结束后,他们总结得出:通过金属与 反应或金属与盐溶液反应可以比较金属活动性强弱。
杨明同学在阅读课外资料时了解到铁的氧化物有氧化铁、四氧化三铁(能被磁铁吸引)和黑色的氧化亚铁三种,这三种氧化物都能与酸发生反应而溶解。联系课堂上学过的知识,他提出了以下两个问题,请你与他一起探讨问题。
[问题1]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料]1.四氧化三铁和氧化铁的分解温度、铁的熔点见表;
2.氧化铁高温时分解成四氧化三铁和氧气
[理论探讨]根据实验现象,并结合下表中数据,可推知铁在氧气里燃烧时产生的高温应在___ __之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4。
| |
Fe3O4 |
Fe2O3 |
铁 |
| 分解温度/℃ |
1538 |
1400 |
— |
| 熔点/℃ |
— |
— |
1535 |
[拓展延伸]
(1)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式 。
(2)有些超市的食品密封包装袋内使用铁粉做双吸剂粉末,双吸剂的作用是 。
[问题2]实验室用一氧化碳在高温下还原氧化铁,实验结束后的固体生成物中除铁外还有可能含有其他铁的氧化物。为了进一步验证其固体成分,杨明同学又设计了如下实验:
[步骤一]将黑色固体研磨后,取少量加入足量稀盐酸溶液中固体全部溶解,观察到有气泡出现,溶液未变黄色,据此得出的结论是一定有 。
[步骤二]取步骤一研磨后的黑色固体用磁铁吸引,如果 ,说明黑色固体只有单质铁;
如果 说明黑色固体为单质铁和氧化亚铁。
(1)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前10min内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 实验编号 |
试剂 |
前10 min 内产生的氢气体积(mL) |
|
| 不同纯度的锌 |
不同体积和浓度的稀硫酸 |
||
| a |
纯锌 |
30 mL 30 % |
564.3 |
| b |
含杂质的锌 |
30 mL 30 % |
634.7 |
| c |
纯锌 |
30 mL 20 % |
449.3 |
| d |
纯锌 |
40 mL 30 % |
602.8 |
①比较实验a和实验b,可以得到的结论是 。
②为了研究硫酸浓度对反应快慢的影响,需比较实验 和实验 (填编号)。
③控制其他条件相同,需控制的条件是 (例举一种条件即可)。
(2)利用锌皮和稀硫酸制取氢气,并测定锌皮中锌的质量分数
制取氢气的实验操作有:
a.收集气体;
b.向锥形瓶里装锌皮;
c.连接仪器,检查装置气密性;
d.向长颈漏斗中注入稀硫酸;
e.装配仪器。
正确的操作顺序为 。
(3)测定锌皮中锌的质量分数:已知该锌皮中含有少量杂质铁,将该锌皮放入如下图所示的盛有稀硫酸的锥形瓶中,多次实验后,取平均值所得数据如下表:
| 反应前 |
充分反应后装置及反应剩余物质质量 |
|
| 装置和足量的稀硫酸质量 |
锌皮质量 |
|
| 342.2g |
15.8g |
357.5g |
(15分)人类的生活和生产都离不开金属材料。
(1)铁是目前年产量最高的金属。
①高炉炼铁时需要的主要原料有铁矿石、焦炭、_______等。
②炼铁的反应原理主要是利用CO把铁从铁矿石中______出来(填“置换”或“还原”),表示该原理的化学方程式是__ _ _。
③下列说法正确的是__________________。(填字母序号)
| A.铁生锈就是铁与空气中的氧气发生的化学反应 |
| B.回收废旧金属有利于节约金属资源 |
| C.铁丝在氧气中剧烈燃烧,火星四射,生成氧化铁 |
| D.在铁桶中加入硫酸铜溶液和石灰乳来配制农药波尔多液 |
(2)请你参与探究几种常见金属饰品所含金属的相关活动,并回答下列问题。
【提出问题】Ⅰ.怎样鉴别真假黄金?Ⅱ.怎样确定钯的金属活动性?
【查阅资料】假黄金通常是黄铜(Cu﹣Zn合金);
钯(Pd)呈银白色,有金属光泽,可用作饰品
【实验药品】钯(Pd)、铂(Pt)、稀盐酸、硝酸银溶液和氯化钯(PdCl2)溶液
【实验探究】
①鉴别黄金样品的真假:取黄金样品于试管中,滴加稀盐酸后,观察样品表面有气泡产生,说明此样品为 (填“真”或“假”)黄金,其中发生的反应方程式为________。
②探究钯的金属活动性:依据生活经验,同学们猜测钯的活动性可能与银和铂相近,于是他们利用上述药品进行如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 把钯浸入硝酸银溶液中 |
无明显现象 |
钯的活动性比银 。(填“强”或“弱”) |
| 把铂浸入氯化钯溶液中 |
_________ |
钯的活动性比铂强。 |
初步得出结论:钯、银、铂的金属活动性由强到弱的顺序为____ 。
(3)现用一定量的AgNO3和Cu(NO3)2混合溶液,进行了如图所示的实验,并对溶液A和固体B的成分进行了分析和研究。
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】
①只有Zn(NO)3
②有Zn(NO3)2、AgNO3
③有Zn(NO3)2、Cu(NO3)2
④有Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是__ _____(填标号),其理由是____ ___。
【实验探究】根据下表中的实验步骤及现象,完成表中的实验结论
| 实验步骤 |
现象 |
实验结论 |
| 取少量固体B,滴加稀盐酸 |
有气泡产生 |
溶液A中的溶质成分符合猜想 _, 固体B中的金属成分有 _种。 |
化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属。流程如下:
请回答:
(1)四种金属的活动性顺序由强到弱的是 ;
(2)写出步骤②中产生气体的化学方程式 ;
(3)写出步骤③中的反应现象 ;
(4)滤液C中一定含有的溶质是 可能含有的溶质是 ;
同学们通过实验来验证Cu、Fe、Ag三种金属的活动性顺序。实验室提供的药品有:Cu(NO3)2溶液、AgNO3溶液、Fe(NO3)2溶液、稀盐酸、铜丝、铁丝、银丝。
(1)小华同学设计并完成了如下实验:
①把铁丝插入装有稀盐酸的试管中; ②把铜丝插入装有稀盐酸的试管中;
③把银丝插入装有稀盐酸的试管中; ④把铜丝插入装有AgNO3溶液的试管中。
观察到①中的实验现象是 ,④中的化学方程式是 。你认为小华所做的实验 (填序号)是多余的。
(2)后来,小贝只选用了上述药品中的三种,通过两步实验,也达到了实验目的。他选用的三种药品是 (写出一种药品组合即可)。
小贝还想探究Zn、Fe、Cu的活动性顺序,设计了如图的两个实验:小贝以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是 。
小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2. Fe>Cu >Cr; 猜想3.你的猜想是 。
【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
【结论与解释】
(1)小聪得到的结论是猜想 正确。
(2)实验前用砂纸打磨金属片的目的是 。
【知识运用】
将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行。若能进行,
请你写出反应的化学方程式 。
(1)目前世界上一半以上的铜用于电力和电信工业,是因为铜具有 (填字母)
| A.导热性 | B.延展性 | C.导电性 | D.金属光泽 |
(2)我国第四套人民币的硬币从1999年开始发行,一元为钢芯镀镍(Ni),五角币为钢芯镀铜合金,一角币为铝合金或不锈钢。在选择铸造硬币的材料时需要考虑的因素是有 (填一条即可)。
①镍能与盐酸或稀硫酸反应,生成可溶于水的正二价镍的化合物,并放出氢气。其反应没有铁与酸反应剧烈。镍与盐酸反应的化学方程式为 .
②用镍片、硫酸亚铁溶液和 溶液做实验也能判断Ni 、Fe、Cu的金属活动性顺序。三种金属的活动性顺序为 。
(3)若将一定质量的Zn放入CuCl2和MgCl2的混合溶液中,充分反应后过滤,所得滤液中一定含有的溶质是 。
(4)活动课上小明将一枚五角币放在酒精灯火焰上加热片刻,发现表面变黑。
【假设与预测】假设Ⅰ.五角币加热变黑,是因为酒精灯内焰的黑烟附着在五角币的镀铜上;
假设Ⅱ.五角币加热变黑,是因为五角币上的镀铜与 ______发生了化学反应。
【实验与事实】
实验一:用洁净的干布擦一擦五角币上的黑色物质,黑色物质不易被擦去;再另取一枚五角币放在石棉网上,用酒精灯加热片刻,五角币也变黑。
实验二:取一块铜片放入小试管中并塞上橡皮塞,然后用酒精灯加热直至试管中铜片变黑;再将铜片反转到另一面,加热片刻,铜片不再变黑。
【解释与结论】上述实验一和实验二证实,假设 __ ___ 不成立。
【表达与交流】铜片在空气中加热,发生的化学反应方程式为___ ___ 。
学习了金属的化学性质后,某兴趣小组进行了如下实验:将足量镁条加入到氯化铁溶液中,观察到镁条表面有气泡产生,一段时间后,有黑色固体粉末生成。
【提出问题】产生气体是什么物质?
【作出猜想】猜想一:可能是氧气;猜想二:可能是氢气;猜想三:可能是二氧化碳。
【交流讨论】大家思考后,一致认为猜想三不合理,其理由是_____________________。
【实验与结论】
| 实验步骤 |
现象 |
结论 |
| ①先用试管收集该气体,再将带火星的木条伸入试管 |
|
猜想一不成立 |
| ②用尖嘴导管将气体导出并引燃,同时在上方放一块干冷的玻璃片 |
该气体能燃烧,且玻璃片上 有 出现 |
猜想二成立 |
【继续探究】某同学想探究黑色粉末可能是铁,你想到的物理方法是 。
同学们一起探究铝、铁、铜三种金属的活动性,小刚同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管,取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。
(1)填表
| 实验步骤 |
观察到的现象 |
| ①在试管中取少量盐酸,插入铁丝,充分作用。 |
_ |
| ②在①所得的溶液中,插入 ,充分作用。 |
无明显现象 |
| ③在②所得的溶液中插入 ,充分作用。 |
|
结论:金属活动性Al > Fe > Cu
(2)将铝丝插入前应进行的操作是 ;
(3)小华同学认为在小刚设计的方案中,只要补充一个实验,就可得出Al > Fe > H >Cu的结论。小华要补充的实验是 ;
(4)小强同学认为要得到Al > Fe > H >Cu的结论,还要做将铝丝插入稀盐酸的实验,你认为(是否) 有必要做补充实验,原因是 。
化学兴趣小组的同学对实验室一瓶没有标签的银白色金属X,展开探究活动。
【实验目的】X金属活动性顺序中的相对位置关系。
【实验探究】取形状、大小相同的X、Cu 、Zn三种金属薄片,用砂纸打磨光亮,分别放入三份等体积、等质量分数的稀硫酸溶液中,观察现象。
| 实验 |
X放入稀硫酸中 |
Zn放入稀硫酸中 |
Cu放入稀硫酸中 |
| 实验现象 |
金属X表面产生气泡缓慢 |
金属锌表面产生气泡较快 |
金属铜表面无气泡 |
【实验结论】三种金属在金属活动性顺序中的相对位置由弱到强的是 。
【问题与思考】用砂纸打磨金属片的目的是 。
【拓展探究】
(1)兴趣小组的同学将锌片放入一定量和混合溶液中,反应一段时间后,过滤,对蓝色滤液的组成进行探究。
(2)猜想:①滤液中的溶质为硝酸锌和硝酸铜;
②滤液中的溶质为硝酸锌、硝酸铜和硝酸银。
(3)请你完成下面实验,验证猜想②成立。
| 实验操作 |
实验现象 |
实验结论 |
| 取少量的滤液于试管中,在滤液中加入 。 |
|
猜想②成立 |
【归纳总结】锌和硝酸银溶液反应的化学方程式是 。
在学习金属的性质时,老师拿来了三种外观酷似金、银、铜的样品,同学们对样品进行以下探究:
①用锤子砸"金",样品粉碎;
②加入稀盐酸:"金"和"铜"没有现象,"银"有大量气泡产生;
③测定密度:"金"
,"银"
,"铜"
.
④查阅几种常见金属的密度,如下表:
| 金属 |
金 |
银 |
铜 |
铁 |
锌 |
| 密度(g/cm3) |
19.3 |
10.5 |
8.9 |
7.9 |
7.1 |
(1)根据以上探究,确定"金"是假的理由有哪些?推测"银"可能是什么金属,依据是什么?
(2)已知"铜"只有表面镀了一薄层致密的铜,内部是锌.若不粉碎"铜",选用稀硫酸和锌粉,测定一定质量"铜"样品中铜的质量,设计实验方案.
暖水瓶内胆玻璃上镀有一层银,某活动小组利用废弃的暖水瓶内胆设计如图所示实验(其中分离混合物的操作已略去)。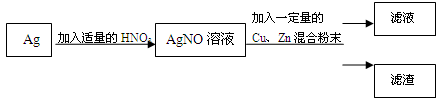
资料:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O 3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O
⑴根据资料,不考虑反应速率的差异,实验时选用浓硝酸还是稀硝酸?说明理由。
⑵滤渣成分可能存在多种情况,推断其中成分最简单的滤渣对应的滤液中溶质的组成。
⑶设计实验对成分最复杂的滤渣进行验证,填写实验报告。
| 滤渣成分 |
实验操作及现象 |
| |
|
材料:2013年12月2日,“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察。12月15日晚,“嫦娥三号”着陆器和巡视器(玉兔月球车)成功分离,顺利互拍,任务取得圆满成功。长征三号运载火箭主要用于发射地球同步轨道有效载荷,它的一子级和二子级使用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作推进剂,三子级则使用效能更高的液氢(H2)和液氧(O2)。
(1)“长征三号”三子级火箭用液氢做燃料,其反应的化学方程式为 ,使用液氢做燃料的优点有: (填一条)。
(2)下列有关偏二甲肼(C2H8N2)的叙述正确的是
| A.由2个碳原子,4个氢原子,一个氮分子组成 |
| B.由碳、氢、氮三种元素组成 |
| C.由2个碳原子,8个氢原子,2个氮原子构成 |
| D.偏二甲肼分子中碳、氢、氮的原子个数比为1:4:1 |
(3)“玉兔”月球车(下图)主体为长方形盒状,车底安有六个轮状的移动装置,顶部两片太阳翼可以打开,太阳翼打开可将太阳能转化成 能,为“玉兔”提供能源的还有锂电池和核电池。“玉兔号”对“车轮”要求极高。月球车底盘和车轮由铝合金材料制成,这是由于铝合金具有质轻坚硬的特性。
(4)看见玉兔车金灿灿的车身后,小聪想到家里新换的水龙头。他从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你参与。
【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu >Cr; 猜想3.你的猜想是 。
【查阅资料】
① 铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
② 铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
| 实验 |
试管1 |
试管2 |
试管3 |
| 实验 操作 |
 |
 |
 |
| 实验 现象 |
铁片表面产生气泡较慢,溶液变为浅绿色 |
铬片表面产生气泡较快,溶液变成为蓝色 |
|
【结论与解释】
① 小聪得到的结论是猜想 正确。
② 实验前用砂纸打磨金属片的目的是 。
【知识运用】
将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行。若能进行,请你写出 。
探究活动一:在室温条件下进行如图所示实验。已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等。
① 该实验的目的是 ⑻ 、 ⑼ 。
两支长颈漏斗中产生的现象的不同之处是
⑽ 。
② 若实验所用的金属均过量,则甲装置中产生的H2 比乙装置中产生的H2质量 ⑾ (填“多”、“少”或“一样多”)。
探究活动二:为除去铜屑中混有的少量铁屑,并测定该混合物中铁的质量分数,现有如下A、B两组实验方案。
A:称取一定质量的样品,加入足量的稀盐酸,搅拌、过滤、洗涤、干燥、称量所得固体质量。
B:称取一定质量的样品,加入一定量的硫酸铜溶液,搅拌、 过滤、洗涤、干燥、称量所得固体质量。
③ 两种方案,你认为不能达到目的是 ⑿ (填“A”或“B”),理由是 ⒀ 。
④ 在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数 ⒁ (填“偏大”、“偏小”、“不变”或“无法判断”)。