金属与我们密切相关。
(1)铝不易锈蚀的主要原因是________(填字母序号)。
A.铝不会与酸反应
B.铝不会与空气中的氧气反应
C.铝表面的氧化膜具有保护作用
(2)铁粉可用于食品保鲜的原理:铁生锈时能吸收________和_________,使食品保持干燥并防止氧化变质。颗粒大小达到纳米级的单质铁在空气中受撞击时,燃烧生成四氧化三铁,反应的化学方程式为_____________________________________。
铁是生产、生活中应用很广泛的一种金属。下列是与铁的性质有关的部分实验图,请回答下列问题。
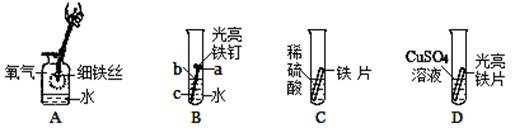
(1)A中发生反应的化学方程式是 ,集气瓶中水的作用是 。
(2)铁生锈的条件是 ,B中铁钉最易生锈的部位是 (填“a”、“b”或“c”)。
(3)C试管中刚好完全反应,得到溶液中溶质的化学式是 。
(4)D中反应一段时间后,现象是 ,试管内固体质量比反应前增大,据此推断,试管内溶液质量与反应前相比 (填“增大”、“不变”或“减小”)。
(4分)人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。(1)现代社会使用大量的钢铁,钢铁与 同时接触容易生锈造成损失,在钢铁表面采用 方法可以防止钢铁生锈。
(2)波尔多液是由硫酸铜和熟石灰加水配制而成,不能用铁制容器配制的原因是(用化学方程式表示) 。
请根据常见金属性质回答问题:
(1)将以下常见金属的活动顺序补充完整。
(2)从Mg、Zn、Cu、Fe中选出适当的物质与稀硫酸反应,写出反应的化学方程式 (写一个即可).
(3)在Mg(NO3)2和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中加入稀硫酸,有气泡产生,则滤出的固体中一定含有______________。
金属在生产生活中应用广泛.
(1)铝可以制成铝箔,这是利用金属铝具有良好的 性.
(2)铁制品生锈的条件是 ,用稀盐酸除铁锈反应的化学方程式是 .
(3)我国是世界上最早采用湿法冶金提取铜的国家,铁与硫酸铜溶液反应的化学方程式是 .工业上冶炼铝,是将铝矿石(主要成分是Al2O3)在熔融条件下通电分解,其反应的化学方程式是 .
(4)现有两种金属单质组成的混合物.向100g某稀盐酸中加入该混合物,混合物的质量与生成氢气的质量关系如图所示.
下列说法正确的是 (填序号).
a.若混合物为Zn、Al,则m可能是0.2g
b.若混合物为Zn、Cu,则m一定大于0.2g
c.若混合物为Fe、Al,则稀盐酸中溶质质量分数一定大于7.3%
d.若混合物为Fe、Cu,m为0.1g,则该混合物中Fe的质量分数一定是50%
钢铁是使用最多的金属材料。
(1)下图为实验室炼铁的装置图,A中反应的化学方程式是 ;将反应后的气体通过装置B和C,收集较纯净的CO并循环使用,B中应盛放的试剂是 浓溶液。
(2)工业上可用酸清洗锈蚀的金属。将生锈的铁片和生锈的铜片[铜锈的成分Cu2(OH)2CO3]同时放入一定量盐酸中,可能发生的化学反应有:
①铜锈溶解:Cu2(OH)2CO3+ 4HCl= 2CuCl2 + 3X + CO2↑,则X的化学式为 ;
②铁锈溶解:化学方程式为 ;
③有金属单质生成:化学方程式为 。
(3)某化学小组欲测定一种钢样品中铁的含量,实验操作如图所示,实验结果记录如下表:
| 反应时间 |
t0 |
t1 |
t2 |
t3 |
| 烧杯和药品质量/g |
55.7 |
55.6 |
55.5 |
55.5 |
①经计算,这种钢样品中铁的含量是 % (精确到0.1%)。
②有同学提出,灼烧可使钢中的碳转化为二氧化碳,钢样品质量会减轻。但是他们将一定量的钢样品灼烧后,发现质量反而增加了,其原因是 。
我国建设高铁在促进“一带一路”建设中发挥独特的作用。试回答:
(1)铺设火车道轨,一般用的合金钢是___________钢材;
(2)连接导线的电刷多采用石墨板,是利用其三个优点是______________________;
(3)高铁车体采用大量的铝合金,其应用的重要目的是(答三点)_______________________________,运行时,其能量转化是______________________;
(4)乘坐高铁在不超重的前提下,下列哪些物品不能带上列车_____________(填序号)
①面粉 ②硝酸钾化肥 ③浓硫酸 ④酒精 ⑤红磷。
铁及其化合物在生活中应用广泛.
(1)硫酸亚铁常作补铁剂,人体缺铁会造成 (填字母序号).
A.骨质疏松 B.贫血 C.佝偻病 D.夜盲症
(2)铁制品长期使用容易生锈,铁生锈的条件是.在铁制品表面镀铬(Cr)可以防止铁生锈,工业上获取镀铬原料三氧化铬的化学反应方程式为:Na2Cr2O7+X=2CrO3+Na2SO4+H2O,其中X的化学式为 .
(3)为探究锌、铁、铜三种金属的活动性,以及他们和氢元素的位置关系,小明设计了如下实验:
①小莉提出:上述实验中,省略某些实验也能达到目的.能被省略的实验是 (填字母序号).
②将反应后的废液倒入废液缸中,过滤,向所得滤液中加入铁粉,无气泡产生.则下列说法中,正确的是
(填字母序号).
A.一定含有硫酸锌 B.可能含有硫酸铜
C.滤渣中一定含有Fe、Cu D.滤渣中可能含有Zn、Fe、Cu.
用化学方程式回答下列问题:
(1)常用生石灰作食品干燥剂 ;
(2)铝具有良好的抗腐蚀性能 ;
(3)工业上用赤铁矿作原料炼铁的化学方程式为 ;
(4)工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印迹,此过程中发生的化学方程式为 。
金属在生产生活中应用广泛.
(1)最初输水管材用铸铁,目前多用塑料管,输送热水一般用铜管.下列管材不属于金属材料的是 (填字母序号).
(2)钢铁生锈的条件是 与氧气和水同时接触 .废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为 .
(3)某同学将一小包铜粉和铁粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液.
①铜和硝酸银溶液反应的化学方程式为 .
②滤液中的溶质组成可能为 .
(共3分)青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具。
(1)图1中标示的物质属于金属材料的有 (填序号)。
(2)灯管后面的反光片为铝箔。铝块能制成铝箔是利用了铝的 性。
(3)铝比铁活泼,但铝箔比铁螺丝钉耐腐蚀。铝制品耐腐蚀的原因是 。
金属在生产和生活中有广泛的应用.
(1)如图1金属制品的用途中,利用金属导热性的是 (填字母序号).
(2)早在西汉时期,人们主要采用“湿法冶金”.如将铁浸入硫酸铜溶液中,该反应的化学方程式为
,该反应的基本反应类型为 ;现代工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为 .
(3)为验证Fe、Cu、Ag三种金属的活动性顺序,某化学兴趣小组设计了如图2所示的四个实验.其中不必进行的是 .
(4)某电镀厂排放的污水中含有硫酸铜、硫酸锌和硫酸亚铁,某化学小组将一定量的锌加入到一定量的该污水中,充分反应后过滤,向滤渣中加入盐酸,有气泡产生.滤渣和滤液中一定含有的物质是 .
已知镉(Cd)的金属活动性与铁、锌相近,镉元素在化合物中常显+2价.
(1)将镉丝插入下列溶液能发生反应的化学方程式是 ;
①NaCl溶液 ②乙醇溶液 ③AgNO3溶液 ④KOH溶液
(2)镍镉电池应用广泛,为了防止污染环境,将废旧镍镉电池中回收镉的一种方法如下:
步骤1:将废旧电池破碎成细颗粒后培烧,将镉转化为氧化镉;
步骤2:将含氧化镉的细颗粒和炭粉混合后,隔绝空气加热至1200℃,可得镉蒸气和一氧化碳.步骤2中氧化镉变成镉的化学方程式是 .
铁是生产、生活中应用广泛的金属材料。
(1)酸菜等酸性的食物不宜用铁质器具长期盛放,因为______________。
(2)为减缓海水对铁质海轮外壳的腐蚀,制造海轮时,会在海轮船底四周镶嵌比铁更活泼的金属。下列金属适宜船底镶嵌的是________(填选项)。
| A.Pb(铅) | B.Cu | C.Pt(铂) | D.Zn |
(3)对铁“发蓝”处理,其表面将形成致密氧化膜而有效避免腐蚀。
①致密氧化膜能有效阻止铁锈蚀的原因是___________________。
②“发蓝”过程的化学方程式如下,式中X的化学式为_________。
36Fe + 4NaNO2 + 9NaNO3 + 26H2O =" 12X" + 13NaOH + 13NH3↑
③为检验“发蓝”处理的铁质零件表面是否形成致密氧化膜,将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质。由此可知该零件“发蓝”处理效果______(填“好”或“不好”),因为_______________(用化学方程式表示).
金属是人类生活中的常用的材料.
(1)下列生活用品中,主要利用金属导热性的是 (填字母序号).
(2)工业上用赤铁矿(主要成分是氧化铁)冶炼铁的化学方程式是 .
(3)现有锌片、铜片、稀硫酸、硫酸锌溶液和硫酸铜溶液5种物质,某同学欲探究锌和铜的金属活动性顺序,选择的一组试剂是 ,其现象是 .
(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】,他以铜锈为原料设计并完成如下实验(杂质不与稀硫酸反应,且不含铜元素.图中部分物质略去).
①溶液C中所含的溶质是 .
②已知铜锈中Cu2(OH)2CO3的质量分数是10%,固体F的质量是1.28g,则铜锈中含Cu的质量分数是
(结果精确至0.1%).