为比较 三种金属的活动性,某同学设计了如图所示实验,由此判断三种金属活动性由强到弱的顺序是()
| A. |
|
| B. |
|
| C. |
|
| D. |
|
为了验证 、 、 三种金属的活动顺序为: 〉 〉 这一结论,下面实验设计合理的是()
| A. | 将 、 两金属片分别放入稀硫酸 |
| B. | 将 、 两金属片分别放入稀硫酸 |
| C. | 将 、 两金属片分别放入 溶液中 |
| D. | 将 、 两金属片分别放入 溶液中 |
根据金属活动性顺序分析,下列描述或判断正确的是( )
| A. | 金属钾能与硫酸锌溶液发生化学反应得到金属锌 |
| B. | 金属铁与硫酸溶液反应后所得溶液的质量比原溶液的质量增大 |
| C. | 在常温下,铝比镁更容易与氧气发生化学反应 |
| D. | 金属铜与氯化银反应得到金属银 |
若已知X、Y、Z三种金属与化合物之间存在化学反应有:①Y + ZCl2 ="=" Z + YCl2、
②X + ZCl2="=Z" + XCl2、③Y + 2HCl==YCl2 + H2↑;又知X与稀盐酸不能发生反应。试推断X、Y、Z三种金属的活动性由强到弱的顺序是
| A.Z>Y>X | B.X>Y>Z | C.Y>X>Z | D.Y>Z>X |
物质不需要发生化学变化就表现出来的性质是( )
A.挥发性B.不稳定性C.可燃性D.腐蚀性
同学们为了比较锌、铁、铜三种金属的活动性, 仅用组内物质就能达到目的的是
①Zn、Fe、Cu、稀硫酸 ②Fe、ZnSO4溶液、CuSO4溶液
③Zn、FeSO4 溶液、CuSO4溶液 ④ Zn、Cu 、FeSO4 溶液
| A.只有④ | B.②和③ | C.①②④ | D.①②③④ |
由下图信息可知,金属活动性最不活泼的是()

| A. | 镁 | B. | 锌 | C. | 铁 | D. | 铜 |
物质的性质决定物质的用途.下列物质的用途体现其化学性质的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
将甲、乙、丙三种金属分别放入试管中,滴加稀硫酸后只有丙金属表面有气体产生;再将乙金属放入甲金属的盐溶液中,乙金属表面有甲析出.则甲、乙、丙三种金属的金属活动性由强到弱的顺序为
| A. | 乙>甲>丙 | B. | 丙>乙>甲 | C. | 乙>丙>甲 | D. | 甲>乙>丙 |
工业冶炼金属锰的原理是 ,该反应属于()
| A. | 置换反应 | B. | 化合反应 | C. | 分解反应 | D. | 复分解反应 |
下列说法正确的是()
| A. | 铁在潮湿的空气中不易生锈 |
| B. | 生铁中的含碳量小于钢中的含碳量 |
| C. | 铝具有良好的抗腐蚀性能是因为表面有一层致密的氧化铝薄膜 |
| D. | 稀盐酸不能用于除去铁锈 |
将铁粉加入到一定量的硝酸银、硝酸铜及硝酸锌的混合溶液中。待充分反应后过滤,再在滤渣中加入稀盐酸,没有气体产生,则在滤液中
| A.只有硝酸锌和水 | B.一定有硝酸锌和硝酸亚铁 |
| C.一定没有硝酸银 | D.如果没有硝酸铜,则一定没有 |
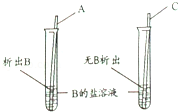
现将 、 两种银白色金属片分别插入硫酸铜溶液中, 表面有铜析出, 无明显变化,则 、 、 的活动性由强到弱的顺序是( )
| A. | B. | C. | D. |
如图,将等质量的锌和铁分别入入左、右试管中,加入等质量、等质量分数的稀盐酸,充分反应后,冷却到室温,金属均有剩余,( 型管内为水,初始液面相平,反应过程中装置气密性良好)下列说法正确的是()

| A. | 右试管中溶液为浅绿色 | B. | 两试管中所得溶液的质量相等 |
| C. | 型管中液面左升右降 | D. | 型管中液面仍相平 |