如图是
,
,
三种固体物质的溶解度曲线,请回答下列问题:

(1)
点的含义是;
(2)若
点混有少量
时,可采用的方法提纯
;
(3)
℃时,能不能配制溶质的质量分数为40%的
溶液?(填"能"或"不能");
(4)
℃时,将
,
,
三种固体物质各30
加入到100
水中,充分溶解,形成不饱和溶液的是;
(5)将
℃时
,
,
三种固体物质的饱和溶液升温到
℃,其溶质的质量分数由大到小的顺序是。
质量分数为30%的某溶液蒸发掉10g水后,溶液的质量分数变为40%,则原溶液的质量是
| A.30g | B.40g | C.50g | D.60g |
为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:

(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是;
(2)发生反应的化学方程式为;
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(x)的比例式为;
(4)该黄铜样品中铜的质量分数是;
(5)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是;
(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干,然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是,再经过某些反应及操作就得到了所需铜盐。
下图是A、B、C三种固体物质在水中的溶解度曲线,据图回答:
(1)有t1℃时A的饱和溶液125g,其中A的质量为_________。
(2)当A物质中混有少量B物质时,通常可采用_________________的方法提纯A。
(3)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃后(升温过程中溶剂量不变),三种溶液中溶质的质量分数由大到小的顺序是____________(填字母)。
如图是甲、乙两种固体物质的溶解度曲线.据图回答:

(1)P点的含义 。
(2)要使接近饱和的甲溶液变成饱和溶液,可采用的方法有 (写出一种),当甲中含有少量乙时,可采用 的方法提纯甲.
(3)30℃时,将40g甲物质放入盛有50g水的烧杯中,所得溶液溶质的质量分数为 .若烧杯内物质升温到50℃(不考虑蒸发 ),溶液中变化的是 (选填序号).
a.溶质的质量 b.溶液的质量 c.溶质的质量分数
(4)从图中还可获得的信息是 、 (答出二条).
如图A、B两种固体物质的溶解度曲线.
(1)t1℃时A、B两物质的溶解度为 g.
(2)使一定量接近饱和的A物质溶液变为饱和溶液采用的一种方法是____________
(3)t1℃时,将一定量B的饱和溶液升温至t2℃,溶质的质量将______ (填“增加”、“减少”或“不变”).
(4)t2℃时,将等质量的A、B两种物质分别加水溶解,配制成其饱和溶液,所得溶液质量的大小关系为: A B(填“>”“=”或“<”).
、
两种固体物质的溶解度曲线如图所示,请根据曲线图回答下列问题。
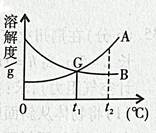
(1)现有常温下
的不饱和溶液,在只要求保持其中溶剂质量不变的条件下,将其变成饱和溶液,可行的方法有。
(2)现有一杯
时含
、
两种物质且均饱和的混合溶液,若要从中分离出少量A的纯净物,其操作方法是。
(3)下列说法正确的是。
①
时,
的溶液中溶质的质量分数一定比B的溶液中溶质的质量分数大;
② 将
,
、
的饱和溶液分别降温至
,此时两溶液中的质量分数相等;
③ 在
时,用两份等量的水分别配制成
、
的饱和溶液,这两种溶液的质量相等;
④ 在
时,用等量的
、
分别配制成两种饱和溶液,测得其质量依次为
和
,则
。
下图是甲、乙两种固体物质的溶解度曲线。据图回答:
(1)10℃时,甲物质的溶解度 乙物质的溶解度(填“>”或“=”或“<”)。
(2)30℃时,等质量的甲、乙两饱和溶液降温到10℃, 析出晶体较多。
(3)20℃时,将50g甲物质放入盛有100g水的烧杯中,最终所得溶液的质量为 g;若将烧杯内物质升温到30℃(不考虑水蒸发),溶液中不变的是 (填序号)。
| A.溶剂的质量 | B.溶液的质量 |
| C.溶质的质量分数 | D.以上都不变 |
(4)30℃时,当甲的饱和溶液中含有少量乙时,若要提纯出较多的甲,应采取的方法是 。
如图是甲、乙、丙三种物质的溶解度曲线。下列说法错误的是

| A. | 时,三种物质的溶解度是丙>乙>甲 |
| B. | 时,甲和丙的饱和溶液溶质质量分数相等 |
| C. | 三种物质的溶解度均随温度的升高而增大 |
| D. | 当甲中混有少量的乙时可用冷却其热饱和溶液的方法提纯 |
、
、
在不同溶剂中的溶解度如下表所示。
表1
、
、
分别在水中的溶解度(
)
|
/℃ |
|||
| 0 |
42 |
7.1 |
35.7 |
| 10 |
51 |
12.2 |
35.8 |
| 20 |
109 |
21.8 |
36.0 |
| 30 |
119 |
39.7 |
36.3 |
表2 常温下,
、
、
分别在乙醇中的溶解度(
)
| 17.3 |
<0.01 |
0.1 |
根据表1和表2提供的数据回答下列问题:
(1)
在水中的溶解度随温度升高而(填"增大"或"减小")
(2)20℃时,饱和食盐水中溶质的质量分数为(计算结果精确到0.1﹪);
(3)为证明
能与
发生反应,小明同学将
通入饱和
的乙醇溶液中。请推测该实验可观察到的现象,推测依据是。
水是生命的源泉,下列变化与水相关。请回答:
①二氧化碳溶于水发生反应的化学方程式是 (1) 。
②自来水厂净水过程中常用到活性炭,其作用是 (2) 。
③铁丝在氧气中燃烧时,集气瓶内放少量水的目的是 (3) 。
④除去粗盐中泥沙等难溶性杂质的实验步骤:

I. 操作a的名称是 (4) ;
II. 三个步骤都用到的玻璃仪器是 (5) 。
⑤甲和乙两种固体物质(不含结晶水)的溶解度曲线如下图所示,回答下列问题:
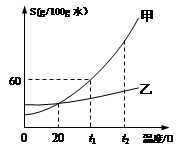
I.在 (6) ℃时,甲和乙两种物质的溶解度相等。
II.t1℃时,将50g固体甲加到50g水中,充分搅拌后所得溶液的质量为 (7) g。
III.甲的饱和溶液中含有少量的乙,由该液体得到固体甲采用的方法是 (8) 。
IV.若将甲物质的不饱和溶液变为饱和溶液,下列说法正确的是 (9) 。
A.溶剂的质量一定变小 B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量变大
⑥下图是对20℃一定质量的丙溶液进行恒温蒸发结晶的实验过程,请回答:
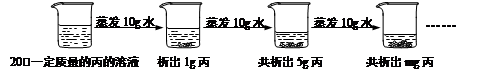
I.蒸发前原溶液是 (10) (填“饱和”或“不饱和”)溶液;m的数值是 (11) 。
II.依据上述实验,你认为丙的溶解度随温度变化的趋势是 (12) (填字母)。
A.随温度升高而增大 B.随温度升高而减小 C.无法判断
如图表示M、N两种物质的饱和溶液的溶质质量分数随温度变化的曲线。现分别向50克M、80克N固体中各加入150克水,并加热至完全溶解,同时各蒸发掉50克水,冷却至t℃,下列分析正确的是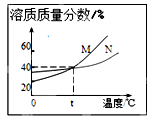
| A.M、N两溶液的溶质质量分数相等 |
| B.只有N析出晶体 |
| C.M、N均有晶体析出 |
| D.M、N两溶液都是饱和溶液。 |
实验室配制50g质量分数为20%的硝酸钾溶液,现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质质量分数为15%的硝酸钾溶液及足量的硝酸钾固体和水,请选用上述药品设计三种配制方案,并填入下表:
| |
配制方案(只要说明配制所需的各种药品及用量即可) |
| 方案一 |
|
| 方案二 |
|
| 方案三 |
|
如图是氯化钠和硫酸钠的溶解度曲线,看图后回答问题:

(1)的溶解度收温度影响变化不大。
(2)温度不变时,若将氯化钠的不饱和溶液变为饱和溶液可采取的方法是。(填一种即可)
(3)40℃时,将30
硫酸钠固体加入到50
水中充分溶解,所得溶液的质量是。
(4)用降温结晶的方法提纯含少量杂质氯化钠的硫酸钠,最佳的温度范围是℃以下,理由是。
溶解度是物质溶解性的定量表示,溶解度曲线可表示物质在不同温度下的溶解度。甲、乙两种物质的溶解度曲线如图所示,根据图示回答下列问题:

(1)甲、乙两种物质中溶解度受温度影响较大的是 物质。
(2)若甲物质中混有少量的乙物质,提纯甲物质最好采取的方法是 (填“降温结晶”或“蒸发结晶”)。
(3)t2℃时,乙物质的溶解度为 g;t2℃时,若将30g乙物质加入到50g水中,所得溶液的溶质质量分数是 (计算结果精确到0.1%)。
(4)将t1℃的甲、乙两物质的饱和溶液(均无固体物质剩余)升温到t2℃时,所得甲物质溶液的溶质质量分数 乙物质溶液的溶质质量分数(填“大于”“小于”“等于”之一)。