在拓展性课程活动中,小明利用以下常见物品验证酸的一些性质:
白醋(含3%的醋酸)、食品干燥剂(主要成分是CaO)、鸡蛋壳、牵牛花汁液、铁钉、苏打(碳酸钠).
【查阅资料】牵牛花汁液在酸性溶液中显红色,在中性溶液中显紫色,在碱性溶液中显蓝色.
【实验过程】
(1)在鸡蛋壳上滴加白醋,产生无色、无味的气体,该气体能使澄清石灰水变浑浊,则鸡蛋壳中一定含有 (用离子符号表示).
(2)小明知道酸能够与铁发生化学反应产生氢气,但当他将足量的白醋加入放有铁钉的容器中,没有看到明显的气泡产生.小明很疑惑,于是提出猜想:气泡不明显可能与酸的浓度和种类有关.要验证与酸的浓度有关,应选择下列试剂中的 (选填编号).
A.3%的盐酸 B.5%的醋酸 C.5%的盐酸
(3)小明利用已有物品还想验证酸与碱的反应,请你帮助完成下列实验设计.
| 步骤 |
操作 |
现象 |
| 1 |
将食品干燥剂加入适量清水中,搅拌后静置 |
放出大量的热 |
| 2 |
取步骤1中的上层清液,先加入牵牛花汁液, |
溶液由无色变为蓝色,再变为紫色,最后变为红色 |
【评价反思】科学来源于生活,生活中的许多事物能更好地帮助我们学习和理解科学.
碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究。
【猜想】Mg(OH)Cl分解后产物可能有:Mg、MgCl 2、MgO、HCl气体、H 2O、Cl 2。
【实验一】取少量的Mg(OH)Cl放入大试管中,按如图所示装置进行实验,加热过程中观察到足量硝酸银溶液中有白色沉淀产生,一段时间后,沉淀不再产生,大试管口也没有液滴形成,管内有固体剩余,无其他现象。由此推知Mg(OH)Cl分解后产物中有 气体,无其他气体。
【实验二】取少量实验一的剩余固体于试管中,加入足量稀盐酸,没有气泡产生,由此推知Mg(OH)Cl分解后产物中没有 。
【实验三】再取少量实验一的剩余固体,加入足量稀硝酸,固体全部溶解,再滴入AgNO 3溶液,无沉淀产生,由此推知Mg(OH)Cl分解后产物中没有 。
【结论】Mg(OH)Cl受热分解的化学反应方程式为 。

实验室用如图方法制取氢氧化铜固体.
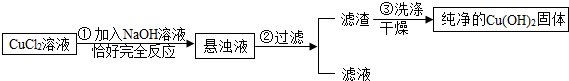
(1)步骤①需配制200克溶质质量分数为4%的NaOH溶液,需NaOH固体 克.
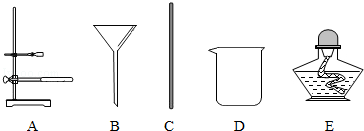
(2)请从图中选取步骤②过滤时需要用到的器材 (可多选).
(3)步骤③中需多次用蒸馏水清洗过滤装置中的滤渣,目的是去除残留在氢氧化铜表面的氯化钠溶液,实验中需要检验清洗后收集到的液体中是否含有氯化钠,写出检验的方法: .
粗盐提纯是初中化学的基础实验之一。
(1)粗盐提纯的实验基本操作步骤为 。
(2)下列仪器中,①仪器G的名称是 ;②粗盐提纯实验中不会用到的仪器(填字母)是 。

(3)经上述操作得到的产品中仍可能含有可溶性的硫酸盐,要检验硫酸盐的存在,其操作为:取少量产品溶于水,并加入过量稀盐酸,再滴加试剂(填化学式) 溶液,观察是否有沉淀产生。
氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。

(1)实验一中,B试管中发生反应的化学方程式为 。
A、B两支试管中共同的实验现象是 。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是 (填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
【提出猜想】猜想1:溶质是NaOH。
猜想2:溶质是NaOH和Na2CO3
猜想3:溶质是Na2CO3
实验操作 |
实验现象 |
实验结论 |
①取D中少量溶液于试管中加入过量稀盐酸 |
|
猜想1不成立 |
②取D中少量溶液于另一试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 |
产生白色沉淀, 酚酞溶液变红 |
猜想2成立 |
【反思与评价】I.小军评价实验操作②中加入Ca(OH)2溶液不正确,理由是 。
若要验证猜想2成立,需将Ca(OH)2溶液换成 溶液。
Ⅱ在实验室中氢氧化钠固体密封保存的原因是 (用文字叙述)
某兴趣小组的同学在实验室做如下实验:小雯探究碳酸钠固体和稀盐酸之间的反应,请写出该反应的化学方程式: ;小棋探究H2SO4、NaOH、CuSO4、BaCl2四种溶液之间的反应。
实验完毕,小雯和小棋将试管中的剩余物都倒入同一大烧杯中,过滤后得到了沉淀A和无色滤液M,并接着进行如下探究:
(查阅资料:Na2SO4溶液呈中性,Na2CO3溶液呈碱性)
实验步骤 |
实验现象 |
实验结论 |
①向所得沉淀A中加入过量稀盐酸,充分反应: |
出现白色沉淀B 和蓝色溶液,没有气泡产生 |
自色沉淀B是 |
②取少量无色滤液M于试管中,滴入酚酞溶液; |
溶液不变色 |
则滤液M 中一定含有的溶质是 |
③取步骤②中溶液,加入适量Na2SO4溶液,充分反应: |
无明显现象 |
|
④另取少量无色滤液M于试管中,加入几粒锌粒; |
|
小棋分析后认为:步骤④中加入锌粒没有必要:滤液M中还可能存在其它成分。如果将步骤④中的锌粒换成另一种试剂,可确定该成分是否存在。请写出小棋用所选试剂鉴定可能存在成分的化学方程式: 。