硫酸是一种常见的酸,完成下列问题。
(1)实验室浓硫酸稀释的方法是 。
(2)为研究稀硫酸的化学性质,某同学进行了如图实验。
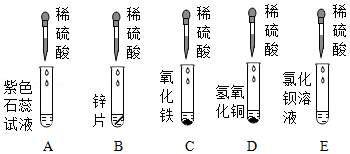
实验中,有气泡产生的反应的化学方程式是 ,溶液有颜色变化的是
(填序号),E试管中观察到的现象是 。
化学学科实践活动课上,老师拿来一包粉末。它是由长期放置在空气中的铁粉和久置的碱石灰干燥剂混合而成,让同学们设计实验进行探究。
【提出问题】固体样品的成分是什么?
【查阅资料】(1)碱石灰干燥剂是CaO和NaOH的混合物。
(2)BaCl2溶液显中性。
【猜想与假设】固体样品中可能含有Fe、Fe2O3、CaO、NaOH、Ca(OH)2、Na2CO3和 等七种物质。
【进行实验】
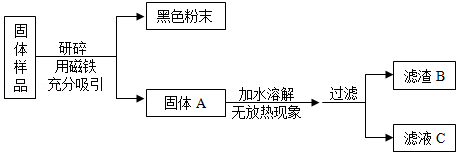
甲组同学对滤渣B的成分进行探究,记录如下:
|
实验操作 |
实验现象 |
实验结论及化学方程式 |
|
取少量滤渣B于试管中,加入足量稀盐酸,将生成的气体通入澄清的石灰水中 |
① ② |
结论:滤渣B中有Fe2O3,CaCO3.实验操作中反应的化学方程式为: (答出一个即可) |
乙组同学对滤液C的成分进行探究,记录如下:
|
实验操作 |
实验现象 |
实验结论 |
|
取少量滤液C于试管中,加入过量BaCl2溶液,静置,向上层清液中滴加无色酚酞试液,振荡 |
①有白色沉淀生成 ②酚酞试液由无色变成红色 |
滤液C中有 |
【解释与结论】(1)乙组同学实验中加入过量BaCl2溶液的目的是 。
(2)通过以上实验探究,该固体样品中能确定一定含有的成分是 。
氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。

(1)实验一中,B试管中发生反应的化学方程式为 。
A、B两支试管中共同的实验现象是 。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是 (填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
【提出猜想】猜想1:溶质是NaOH。
猜想2:溶质是NaOH和Na2CO3
猜想3:溶质是Na2CO3
|
实验操作 |
实验现象 |
实验结论 |
|
①取D中少量溶液于试管中加入过量稀盐酸 |
|
猜想1不成立 |
|
②取D中少量溶液于另一试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 |
产生白色沉淀, 酚酞溶液变红 |
猜想2成立 |
【反思与评价】I.小军评价实验操作②中加入Ca(OH)2溶液不正确,理由是 。
若要验证猜想2成立,需将Ca(OH)2溶液换成 溶液。
Ⅱ在实验室中氢氧化钠固体密封保存的原因是 (用文字叙述)
某兴趣小组的同学在实验室做如下实验:小雯探究碳酸钠固体和稀盐酸之间的反应,请写出该反应的化学方程式: ;小棋探究H2SO4、NaOH、CuSO4、BaCl2四种溶液之间的反应。
实验完毕,小雯和小棋将试管中的剩余物都倒入同一大烧杯中,过滤后得到了沉淀A和无色滤液M,并接着进行如下探究:
(查阅资料:Na2SO4溶液呈中性,Na2CO3溶液呈碱性)
|
实验步骤 |
实验现象 |
实验结论 |
|
①向所得沉淀A中加入过量稀盐酸,充分反应: |
出现白色沉淀B 和蓝色溶液,没有气泡产生 |
自色沉淀B是 |
|
②取少量无色滤液M于试管中,滴入酚酞溶液; |
溶液不变色 |
则滤液M 中一定含有的溶质是 |
|
③取步骤②中溶液,加入适量Na2SO4溶液,充分反应: |
无明显现象 |
|
|
④另取少量无色滤液M于试管中,加入几粒锌粒; |
|
小棋分析后认为:步骤④中加入锌粒没有必要:滤液M中还可能存在其它成分。如果将步骤④中的锌粒换成另一种试剂,可确定该成分是否存在。请写出小棋用所选试剂鉴定可能存在成分的化学方程式: 。
在介绍氢气的制法时,老师告诉同学们,铝丝与一种可以用铁制容器盛装的溶液反应,也会生成氢气。
【提出问题】与铝丝反应的是什么溶液?
【交流讨论】分析后,大家一致认为该溶液不是稀盐酸或稀硫酸,原因是 。
同学们决定进一步探究。老师为同学们提供了该溶液。
【查阅资料】含有不同金属离子的溶液在灼烧时会产生不同颜色的火焰
|
钠 |
钙 |
钾 |
|
黄色 |
砖红色 |
紫色(透过蓝色钴玻璃) |
【实验探究】
①小强取该溶液于试管中,向其中滴加紫色石蕊溶液,发现紫色石蕊溶液变蓝。
②小明用铂丝蘸取该溶液在酒精灯火焰上灼烧,观察到火焰呈黄色。
③有同学提出应向该溶液中滴加稀盐酸,小美取该溶液于试管中,向其中加入足量的稀盐酸后,没有看到明显现象,这样做是为了排除 (填离子符号)的干扰。
【实验结论】该溶液为 溶液。
【交流反思】
①老师告诉同学们,铝与该溶液反应除了生成氢气外,还生成了一种含有AlO 2 ﹣的盐,请写出该反应的化学方程式 。
②金属铝的化学性质较活泼,而生活中使用的铝制品却耐腐蚀,原因是 。