化学丰富了人类的生活。
(1)下列是与人类的生产、生活密切相关的物质:A.碳酸氢钠 B.木炭 C.氮气 D.硬铝。选择相应物质的字母填空:
① 可用于制造飞机
② 可用作冰箱除味剂
③ 可用于治疗胃酸过多症
④ 可用作焊接金属时的保护气
(2)我国科学家屠呦呦因为对青蒿素的研究取得巨大成就而荣获了诺贝尔奖。她用乙醚代替水成功提取出青蒿素,说明研究青蒿素在不同的 (选填“溶质”或“溶剂”)中的溶解性很有价值。为了提高药物在水中或油中的溶解性,对其进行了分子结构修饰,说明了物质的 决定物质的性质。
(3)结合二氧化碳的性质、灭火的原理,分析二氧化碳灭火器可用来扑灭纸质图书档案失火的主要原因。 。
化学在保证人类生存并不断提高生活质量方面起着重要的作用,利用化学综合应用自然资源,以使人类生活得更加美好。目前,人们使用的燃料大多来自化石燃料,如煤、石油、天然气等。煤的综合利用如图所示:

已知高炉内发生的主要化学反应如下:
C+O2 CO2
C+CO2 2CO
3CO+Fe2O3 2Fe+3CO2
(1)将煤隔绝空气加强热的过程是 变化。
(2)粗氨水经提纯后可用作化肥,是因为含有植物所需的 (填元素符号)。
(3)焦炭常作为炼铁工业的原料,请你分析焦炭在炼铁过程中的作用 。
能源利用和环境保护是人类共同关注的问题。
(1)化石燃料主要包括煤、石油和 。
(2)煤燃烧时排放出二氧化硫、二氧化氮等污染物,这些气体或气体在空气中发生反应后的生成物溶于雨水,会形成 。为减少环境污染,我国已大力推广使用脱硫煤。
(3)为控制二氧化碳的排放量,科学家采取新技术,将二氧化碳和氢气在催化剂和加热条件下转化为重要的化工原料乙烯(C 2H 4)和水,反应的化学方程式为 。
(4)乙醇可作燃料。现有一定量乙醇与一定量氧气混合于密闭容器内,在一定条件下反应生成16.2g水,同时得到一氧化碳和二氧化碳的混合物25.2g,参加反应的乙醇的质量为 g,混合物中一氧化碳与二氧化碳的质量比为 (填最简比)。
酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
【实验探究Ⅰ】在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度 ,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化。
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化。
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示。

(1)由图可知,盐酸、氢氧化钠溶液稀释时均 (填“放热”或“吸热”),但它们稀释时温度的变化量远 两溶液混合时温度的变化量。
(2)从微观角度分析,此中和反应的温度变化主要是由于 (填离子符号)两种离子发生反应放出热量的缘故。
[实验探究Ⅱ]
(1)在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。该反应的化学方程式为 。

(2)取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色。同学们对红色溶液中溶质的成分(酚酞除外)进行再探究。
查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色。
作出猜想:猜想一:NaCl
猜想二:NaCl、NaOH
猜想三:NaCl、NaOH和Na2CO3
同学们讨论后一致认为猜想 是错误的,理由是 。
实验验证:取样,滴加 ,无气泡产生,猜想三错误。
原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在 范围内,溶液的颜色变红。
总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色 (填“一定”或“不一定”)变红。
H2SO4是一种重要的化工原料。
(1)H2SO4溶液的pH 7(填“>”、“<”或“=”),请写出用pH试纸测定稀硫酸pH的正确方法 ;
(2)浓硫酸有吸水性,常用作某些气体的干燥剂,下列气体不能用浓硫酸干燥的是 (填写序号);
①H2
②CO2
③NH3
④HCl
(3)实验室常用亚硫酸钠固体(Na2SO3)和70%左右的硫酸溶液发生复分解反应制取SO2,请写出该反应的化学方程式: ;
(4)向160g含有H2SO4和CuSO4的混合溶液中逐滴加入NaOH溶液至过量,产生的沉淀质量与加入NaOH溶液质量的关系如图所示,请写出b点对应溶液的溶质 (填写化学式),原混合溶液中CuSO4的质量分数是 。

小明利用稀硫酸与生锈的铁屑反应制取硫酸亚铁,实验流程如图:
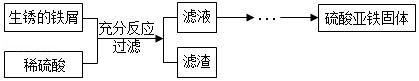
资料:①Fe2(SO4)3+Fe═3FeSO4;②硫酸亚铁容易被氧化为硫酸铁等物质。
(1)配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为98%的浓硫酸 克。
(2)写出该实验中的一条化学方程式(除资料①中的反应外) 。
(3)稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余,其目的是 。
某化学兴趣小组做粗盐提纯实验,并对粗盐的成分作进一步探究。请回答下列问题:
实验一:粗盐提纯
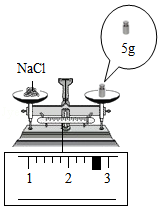
(1)提纯实验多次用到了玻璃棒,请写出该实验中使用玻璃棒的一个作用① ;
(2)蒸发后所得食盐质量② (读数见图)。
实验二:物质检验
[提出问题]食盐中除含有NaCl外,可能还含有什么溶质?
查阅资料一]食盐中可能还含有Na2CO3、Na2SO4等。
[作出猜想]猜想一:含有溶质Na2CO3;
猜想二:含有溶质Na2SO4;
猜想三:③ 。
[查阅资料二]Na2CO3溶液、Na2SO4溶液均可以与BaCl2溶液反应生成白色沉淀,且BaCO3可以溶于盐酸,BaSO4不能溶于盐酸。
[讨论交流]小组同学经讨论后认为:选择BaCl2溶液和稀盐酸两种试剂即可验证猜想。若猜想二正确,则发生反应的化学方程式为④ 。
[实验验证]为验证猜想,小组同学设计了如下实验方案。
Ⅰ.取上述食盐样品少量于试管中,加水溶解,得到澄清透明溶液;
Ⅱ.向溶液中滴加过量的BaCl2溶液,生成白色沉淀,静置;
Ⅲ.静置后弃去清液,加入足量稀盐酸,发现沉淀部分溶解,且有气泡产生。
[实验结论]根据上述实验现象判断⑤ 是正确的(填“猜想一”、“猜想二”或“猜想三”)。
[问题与交流]小组同学在实验报告中记录了如下文字:经实验验证,该食盐样品中仅含有NaCl、Na2CO3和Na2SO4,你认为这个观点⑥ (填“正确”或“错误”)。请说明你选择的理由⑦ 。
阅读下面科普短文
人类目前所消耗的能量主要来自化石能源,化石燃料是由古代生物的遗骸经过一系列复杂变化形成的。化石燃料燃烧时产生的一些物质,如一氧化碳、二氧化硫、未燃烧的碳氢化合物及炭粒、氮的氧化物等排放到空气中,会对空气造成污染。二氧化硫和氮的氧化物在空气中发生反应后的生成物溶于雨水,会形成酸雨。
天然气是一种重要的化石能源,主要含有由碳和氢组成的气态碳氢化合物,其中最主要的是甲烷。不同地区天然气的主要成分有较大差异,我国部分地区天然气的主要成分如下表所示:
CH4 |
C2H6 |
C3H8 |
CO2 |
N2 |
H2S |
|
西南油田 |
93.1098 |
3.8914 |
0.1447 |
1.3092 |
0.5341 |
﹣ |
华北油田 |
80.8430 |
9.7326 |
5.7538 |
0.9288 |
0.3200 |
﹣ |
陕甘宁油田 |
95.9500 |
0.9675 |
0.1367 |
1.5038 |
﹣ |
0.0002 |
注:1.表中数据均表示体积分数。2.“﹣”表示含量过低,当前所用仪器未检出。
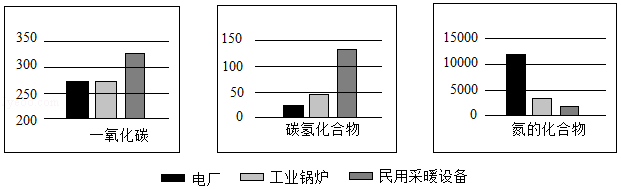
天然气的用途非常广泛,可作为燃料直接使用。天然气在不同设备中燃烧产生的污染物的含量也不尽相同,几种常见设备中天然气燃烧时产生的污染物(kg/Mm3)如图所示:
现代社会对能量的需求量越来越大,化石能源日渐枯竭,人们正在利用和开发其他能源。这些能源的利用,可以部分解决化石能源面临耗尽的问题,并在一定程度上减少了对环境的污染。
依据文章内容,回答下列问题。
(1)化石燃料是 (填“可再生”或“不可再生”)能源,主要包括 、 和天然气。
(2) 油田的天然气中丙烷(C3H8)含量最高,写出丙烷完全燃烧的化学方程式 。
(3)氮的氧化物排放到空气中可形成酸雨,酸雨是pH< 的降雨。
(4)在电厂、工业锅炉和民用采暖设备中天然气燃烧效率最低的是 。
A.电厂 B.工业锅炉 C.民用采暖设备
(5)甲烷除用作燃料外,在工业上也有重要的用途。科学家探索出在一定条件下用甲烷为原料制成了金刚石,写出该反应的化学方程式 。
化学是一门以实验为基础的科学,通过实验可以发现和验证化学原理,获得新的化学知识。请回答下列与化学实验有关的问题:
(1)利用课本实验测定空气里氧气的含量。得到氧气的含量小于 ,可能的原因是: 。(写一种即可)
(2)证明铜和铁金属活动性强弱的实验方法是: 。(写一种即可)
(3)在粗盐提纯实验的步骤中多处用到了玻璃棒,写出其中玻璃棒的作用 。(写一种即可)
学习化学知识和技能,可以帮助我们鉴别和检验物质。
(1)要鉴别白酒与白醋,采取的最简便的方法是 。
(2)现有两瓶失去标签的无色溶液,其中一瓶是氢氧化钙溶液,一瓶是稀盐酸。为了鉴别它们,同学们设计了如表实验方案:先给两瓶溶液贴上标签A、B,然后分别取样进行实验。请将横线部分填写完整:
| |
加入的试剂 |
现象 |
结论 |
| 方案1 |
二氧化碳 |
A中出现白色浑浊,B中无明显现象 |
A是 溶液,B是另一种溶液 |
| 方案2 |
碳酸钠溶液 |
A B |
|
| 方案3 |
试剂X |
﹣﹣ |
①写出方案1中发生反应的化学方程式: 。
②完成方案3:
请从下列提供的试剂中选出所有能鉴别出这两种物质的试剂X: (填字母序号)。
a.酚酞溶液
b.铜
c.镁
d.氧化铜
e.氢氧化铜
f.硝酸钡溶液
③在做完此题后,我们可以总结一下鉴别物质的一般规律:要先分析物质的性质,然后选择恰当的试剂,必须产生 才能达到鉴别物质的目的。
某学习小组用黑枸杞提取液作了以下实验:
实验一:室温时,将蒸馏水和不同pH的硫酸、氢氧化钠溶液,放入14支试管中,分别向每支试管中滴加3滴黑枸杞提取液。实验结果如下:
pH |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
颜色 |
粉红 |
粉红 |
粉红 |
浅紫 |
浅紫 |
紫 |
紫 |
蓝 |
蓝 |
深蓝 |
深蓝 |
灰绿 |
黄 |
黄棕 |
实验二:室温时,向试管中分别加入相同体积的4种物质,各滴加3滴黑枸杞提取液。
实验结果如下:
物质 |
稀盐酸 |
牛奶 |
蒸馏水 |
炉具清洁剂 |
颜色 |
粉红 |
紫 |
紫 |
黄 |
回答下列问题:
(1)炉具清洁剂的pH为 。
(2)根据实验现象,不能确定牛奶呈中性的理由是 。
(3)小苏打溶液的pH为8.3,向小苏打溶液中加3滴黑枸杞提取液,再滴入稀盐酸至过量,观察到的实验现象为 。
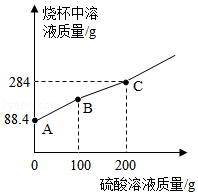
现有盛88.4g Na2CO3和NaOH混合溶液的大烧杯,向其中滴加质量分数为9.8%的H2SO4溶液,充分搅拌,烧杯中溶液的质量与滴加H2SO4溶液的质量关系如图所示,回答下列问题:
(1)写出AB段发生反应的化学方程式 。
(2)BC段可以观察到大烧杯的溶液中有气泡产生,则生成气体的质量为 g。
(3)B点时,大烧杯中的溶液pH 7(填“>”、“=”或“<”)。
(4)C点时,所得溶液为不饱和溶液。求溶液中溶质的质量分数。(写出计算过程)
某化学兴趣小组利用“化学喷泉”设计了如下实验:20℃时,用250mL圆底烧瓶收集一瓶纯净的CO2,按如图组装装置。用注射器缓缓注入3mL NaOH溶液,轻轻振荡烧瓶,打开止水夹,玻璃导管尖嘴处很快产生“喷泉”,与此同时,C、E装置中发生连锁反应。回答下列问题:

(1)图中仪器X的名称是 。
(2)注入NaOH溶液后,烧瓶内发生反应的化学方程式是 。
(3)“连锁反应”后,C试管中溶液的颜色变化为 ;E试管中的现象为 ,反应的化学方程式为 。
(4)实验结束后,同学们发现圆底烧瓶中溶液呈红色,由此认为烧瓶中一定还有NaOH剩余,你认为是否正确? ,说明原因: 。
化学实验是进行科学探究的重要方式。
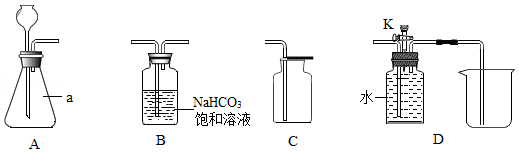
(说明:NaHCO 3饱和溶液的作用是吸收氯化氢气体;装置气密性良好;其他连接装置略)
实验一 氧气的实验室制取
(1)写出图中标号a仪器的名称: 。
(2)用A、C装置制取氧气,所需药品是 。
实验二:制取较纯净的CO 2并探究其性质
[药品准备]将30g质量分数为36%的浓盐酸稀释为9%的稀盐酸
(3)计算加入水的体积为 mL.(水的密度为1.0g/cm 3)
(4)配制稀盐酸时所需仪器有 (填序号)。
①量筒 ②玻璃棒 ③蒸发皿 ④胶头滴管 ⑤烧杯 ⑥托盘天平
[操作步骤]
步骤一:在A装置中加入足量石灰石,依次连接A、B、C装置,再向A中加入适量的稀盐酸。一段时间后,经检验A、B装置内的空气已排净。写出A中发生反应的化学方程式: 。
步骤二:待A中反应停止后,拆下C装置,再将D装置与A、B连接,关闭活塞K, (补全实验步骤),在D中收集实验所需的较纯净的CO 2。
步骤三:打开活塞K,用一支50mL注射器从D中缓慢抽取20mL CO 2,关闭K,再抽取20mL滴有紫色石蕊溶液的水溶液,用橡皮塞堵住注射器的针孔,轻轻振荡。观察到的现象: 。
[问题交流]步骤一中能充分证明A、B装置内的空气已排净的可靠方法是 。
[后续探究]……