化学在改善人类生存环境,提高生活质量方面起着重要作用。
[改善环境]温室效应和酸雨会威胁珊瑚礁生存,我国开展了南海珊瑚礁生态修复工作。
(1)我们把pH (填“>”、“<”成“=”)5.6的降雨称为酸雨。
(2)为改善生存环境,倡导“低碳”生活,建议使用清洁能源。写出一种常见的清洁能源 。
[探测资源]近期,我国向月球背面成功发射一颗中继通信卫星,助力探测月球资源。
(1)月球上有丰富的核能原料He﹣3,He的原子结构示意图为 (填字母序号)
(2)月球土壤中有天然的铁、铅、银等金属颗粒。根据铁锈蚀的条件分析,铁在月球上不易锈蚀的原因可能是 。
[研发材料]中国芯彰显中国“智”造,芯片的基材主要是高纯硅。
(1)硅元素在元素周期表中的信息如图2所示,据图可得到的信息是 (填字母序号)

A.硅元素是非金属元素
B.硅元素的元素符号为Si
(2)如图是一种制备高纯硅的工艺流程图:

[查阅资料]常温下,氯化镁溶液呈中性。
①反应I的化学方程式:2Mg+SiO2 Si+2MgO,该反应属于 反应(填基本反应类型)。反应Ⅱ要在无氧气环境中进行,原因是 (答出一种即可)。
Si+2MgO,该反应属于 反应(填基本反应类型)。反应Ⅱ要在无氧气环境中进行,原因是 (答出一种即可)。
②操作I的名称是过滤,过滤时液面应 (填“高于”或“低于”)滤纸边缘。所得粗硅应充分洗涤,以除去表面可能含有的盐酸、 、(填化学式)。
③简要叙述检验盐酸已过量的方法 。
④上述已知生产流程中,可以循环利用的物质是 (填化学式)。
黄铜(铜和锌的合金)因性能优良,被广泛用于制作钱币、饰品和生产中,铜的质量分数在59%﹣65%之间的黄铜性能优良。兴趣小组为了解某黄铜螺母的材料性能进行如下实验:取多个黄铜螺母放入烧杯中,另取80克19.6%的稀硫酸,分四次等质量加入,每次均充分反应,实验过程数据记录如表。
实验次数 |
1 |
2 |
3 |
4 |
稀硫酸的用量/克 |
20 |
20 |
20 |
20 |
剩余固体的质量/克 |
20.0 |
17.4 |
14.8 |
13.5 |
分析上述数据,请回答下列问题:
(1)第4次实验结束后溶液的pH 7(选填“>”“=”或“<”)。
(2)配制80克溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸(密度为1.84克/厘米3)多少毫升?(精确到小数点后一位)
(3)通过计算说明该黄铜螺母的材料性能是否优良。
酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如表(微溶物视为可溶物):
实验 |
A+B |
A+C |
A+D |
B+C |
现象 |
产生气体 |
产生沉淀 |
产生沉淀 |
产生沉淀 |
①写出溶液B、C中溶质的化学式:B ,C 。
②写出溶液A与D反应的化学方程式 。
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:
NaCl+H2O+NH3+CO2=NaHCO3↓+X;
2NaHCO3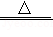 Na2CO3+H2O+CO2↑等。
Na2CO3+H2O+CO2↑等。
回答下列问题:
①X的化学式为 。
②将碳酸钠和碳酸氢钠的混合物l0g充分加热至质量不再改变,冷却,称量剩余固体质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为 (写最简比)。
小明利用稀硫酸与生锈的铁屑反应制取硫酸亚铁,实验流程如图:
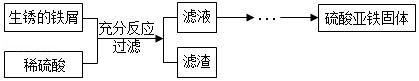
资料:①Fe2(SO4)3+Fe═3FeSO4;②硫酸亚铁容易被氧化为硫酸铁等物质。
(1)配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为98%的浓硫酸 克。
(2)写出该实验中的一条化学方程式(除资料①中的反应外) 。
(3)稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余,其目的是 。
小红和小明通过合作交流,完成了CO2的实验室制取,并进行了相关问题的思考和讨论。(查阅资料:氯化钙溶液呈中性)
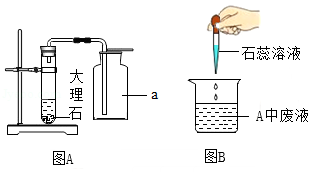
(1)仪器a的名称是 ;
(2)块状大理石装入试管内的基本操作是 ;
(3)试管内发生反应的化学方程式是 ;
(4)烧杯中溶液变红,他们分析废液呈酸性的一种原因是 。
氢氧化钠、氢氧化钙是两种常见的碱。
(1)它们有一些相似的化学性质,其原因是溶液中都含有 。
(2)可作某些气体干燥剂的是 。
(3)用氢氧化钙溶液检验二氧化碳,反应的化学方程式为 。
(4)根据化学方程式计算,用7.4kg氢氧化钙能中和硫酸厂排放的污水中硫酸的质量是多少?
聊城市某学校2019年实验操作模拟训练的一个题目是:鉴别稀硫酸、稀盐酸和氢氧化钠三种无色溶液。小组的同学把标有序号1、2、3的三种溶液分别滴入标有对应序号的三支试管中,向三支试管中滴加酚酞试液,如甲图,鉴别出1号溶液,再向另两支试管中滴加BaCl2溶液,如乙图。请回答:
(1)1号试管中是 溶液。
(2)乙图中2号试管发生化学反应的实质是 (填微粒名称)结合生成白色沉淀。把该试管反应后的物质进行过滤,得到滤液。
[提出问题]除含有酚酞外,滤液中溶质的成分是什么?
[猜想假设]猜想一:HCl;猜想二:HCl和 ;猜想三:HCl和BaCl2。
[进行实验]①取一定量的滤液于试管中,向试管中滴加Na2SO4溶液,有白色沉淀生成,猜想 正确。
②为了验证该滤液的酸碱性,将一片pH试纸放在干燥的玻璃片上,用 蘸取该滤液,滴到试纸上,立即将试纸显示的颜色与pH标准比色卡进行对照,读出pH=5。
[交流拓展]2号试管中滤液显酸性,要将该滤液调至中性,可向滤液中加入适量 (填序号)。
A.铁粉 B.氯化钙溶液 C.石灰石

某化学兴趣小组做粗盐提纯实验,并对粗盐的成分作进一步探究。请回答下列问题:
实验一:粗盐提纯
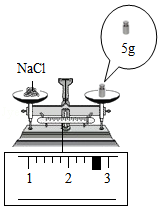
(1)提纯实验多次用到了玻璃棒,请写出该实验中使用玻璃棒的一个作用① ;
(2)蒸发后所得食盐质量② (读数见图)。
实验二:物质检验
[提出问题]食盐中除含有NaCl外,可能还含有什么溶质?
查阅资料一]食盐中可能还含有Na2CO3、Na2SO4等。
[作出猜想]猜想一:含有溶质Na2CO3;
猜想二:含有溶质Na2SO4;
猜想三:③ 。
[查阅资料二]Na2CO3溶液、Na2SO4溶液均可以与BaCl2溶液反应生成白色沉淀,且BaCO3可以溶于盐酸,BaSO4不能溶于盐酸。
[讨论交流]小组同学经讨论后认为:选择BaCl2溶液和稀盐酸两种试剂即可验证猜想。若猜想二正确,则发生反应的化学方程式为④ 。
[实验验证]为验证猜想,小组同学设计了如下实验方案。
Ⅰ.取上述食盐样品少量于试管中,加水溶解,得到澄清透明溶液;
Ⅱ.向溶液中滴加过量的BaCl2溶液,生成白色沉淀,静置;
Ⅲ.静置后弃去清液,加入足量稀盐酸,发现沉淀部分溶解,且有气泡产生。
[实验结论]根据上述实验现象判断⑤ 是正确的(填“猜想一”、“猜想二”或“猜想三”)。
[问题与交流]小组同学在实验报告中记录了如下文字:经实验验证,该食盐样品中仅含有NaCl、Na2CO3和Na2SO4,你认为这个观点⑥ (填“正确”或“错误”)。请说明你选择的理由⑦ 。
生活中经常遇到一些“长相”类似的物质,如家庭制作食品用到的碳酸钠和碳酸氢钠。区分二者,比较简单的方法就是溶解度法(溶解度曲线见图)。
①小亮同学利用这种方法,在室温条件下设计了下面实验,请完善实验内容:
实验步骤 |
现象和结论 |
取两只试管,各倒入10g水,分别向两试管中逐步加入碳酸钠和碳酸氢钠固体,充分振荡、静置、观察现象。 |
至固体不能再溶解为止,其中,固体溶解量少的,所对应的物质是 (填化学式,下同),另一种物质是 |
②现有碳酸钠(2g)、碳酸氢钠(2g)和足量蒸馏水。请仿照上述①中的方法和实验设计,在室温条件下,调整变量、自主设计实验,进一步区分碳酸钠、碳酸氢钠两种物质:
实验步骤 |
现象和结论 |
|
|

盐酸是重要化工产品。
(1)盐酸可用于金属表面除锈,请写出盐酸除铁锈的化学方程式 。
(2)盐酸具有挥发性,在空气中打开盛有浓盐酸的试剂瓶瓶盖,在瓶口处观察到的现象是 。
(3)氨水也具有挥发性,可挥发出氨气。如图,在 a、b 处放有浸泡过浓盐酸或浓氨水的棉花,过一会在 c 处可观察到的现象是 ,a 处是放有浸泡过 的棉花。(已知:①NH3 与 HCl 在空气中相遇可反应生成白色固体 NH4Cl;②相对分子质量越小的气体扩散速度越快)
(4)实验室可用NH4Cl 与Ca(OH)2 固体加热发生复分解反应制取 NH3,请写出此反应的化学方程式 ,收集 NH3可用向 排 空气法。

某学习小组用黑枸杞提取液作了以下实验:
实验一:室温时,将蒸馏水和不同pH的硫酸、氢氧化钠溶液,放入14支试管中,分别向每支试管中滴加3滴黑枸杞提取液。实验结果如下:
pH |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
颜色 |
粉红 |
粉红 |
粉红 |
浅紫 |
浅紫 |
紫 |
紫 |
蓝 |
蓝 |
深蓝 |
深蓝 |
灰绿 |
黄 |
黄棕 |
实验二:室温时,向试管中分别加入相同体积的4种物质,各滴加3滴黑枸杞提取液。
实验结果如下:
物质 |
稀盐酸 |
牛奶 |
蒸馏水 |
炉具清洁剂 |
颜色 |
粉红 |
紫 |
紫 |
黄 |
回答下列问题:
(1)炉具清洁剂的pH为 。
(2)根据实验现象,不能确定牛奶呈中性的理由是 。
(3)小苏打溶液的pH为8.3,向小苏打溶液中加3滴黑枸杞提取液,再滴入稀盐酸至过量,观察到的实验现象为 。
某化学兴趣小组利用“化学喷泉”设计了如下实验:20℃时,用250mL圆底烧瓶收集一瓶纯净的CO2,按如图组装装置。用注射器缓缓注入3mL NaOH溶液,轻轻振荡烧瓶,打开止水夹,玻璃导管尖嘴处很快产生“喷泉”,与此同时,C、E装置中发生连锁反应。回答下列问题:

(1)图中仪器X的名称是 。
(2)注入NaOH溶液后,烧瓶内发生反应的化学方程式是 。
(3)“连锁反应”后,C试管中溶液的颜色变化为 ;E试管中的现象为 ,反应的化学方程式为 。
(4)实验结束后,同学们发现圆底烧瓶中溶液呈红色,由此认为烧瓶中一定还有NaOH剩余,你认为是否正确? ,说明原因: 。
化学实验是进行科学探究的重要方式。
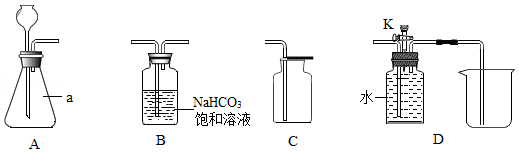
(说明:NaHCO 3饱和溶液的作用是吸收氯化氢气体;装置气密性良好;其他连接装置略)
实验一 氧气的实验室制取
(1)写出图中标号a仪器的名称: 。
(2)用A、C装置制取氧气,所需药品是 。
实验二:制取较纯净的CO 2并探究其性质
[药品准备]将30g质量分数为36%的浓盐酸稀释为9%的稀盐酸
(3)计算加入水的体积为 mL.(水的密度为1.0g/cm 3)
(4)配制稀盐酸时所需仪器有 (填序号)。
①量筒 ②玻璃棒 ③蒸发皿 ④胶头滴管 ⑤烧杯 ⑥托盘天平
[操作步骤]
步骤一:在A装置中加入足量石灰石,依次连接A、B、C装置,再向A中加入适量的稀盐酸。一段时间后,经检验A、B装置内的空气已排净。写出A中发生反应的化学方程式: 。
步骤二:待A中反应停止后,拆下C装置,再将D装置与A、B连接,关闭活塞K, (补全实验步骤),在D中收集实验所需的较纯净的CO 2。
步骤三:打开活塞K,用一支50mL注射器从D中缓慢抽取20mL CO 2,关闭K,再抽取20mL滴有紫色石蕊溶液的水溶液,用橡皮塞堵住注射器的针孔,轻轻振荡。观察到的现象: 。
[问题交流]步骤一中能充分证明A、B装置内的空气已排净的可靠方法是 。
[后续探究]……
"绿水青山就是金山银山",保护环境势在必行。请回答下列问题:
(1)请写出造成水体污染的原因 (答一点即可)。
(2)请写出酸雨的危害 (答一点即可)。
(3)在汽油中加入适量乙醇作为汽车燃料(车用乙醇汽油),请写出使用乙醇汽油的一条优点 。
A~F是六种常见的物质,分别由H、O、C、Cl、Ca五种元素中的两种或三种组成,请回答下列问题:
(1)A是一种氧化物,可用作干燥剂,A与C反应能生成E,A的俗称为 。
(2)B、C常温下均为液体,且组成元素相同,B在一定条件下可生成C,B的化学式为 。
(3)对NaOH溶液依次进行实验,现象如图所示:

①D和E两种物质分别是 、 (写化学式)。
②加入F的溶液后,沉淀溶解并产生大量气泡,用化学方程式表示产生此现象的原因 。
③最后得到的红色溶液中含有的物质有水、石蕊、 ,下列离子不能与该溶液中的离子共存的是 。
a.OH﹣ b.Mg2+ c.CO32﹣ d.NO3﹣。