我国在2017年"世界环境日"(6月5日)确定的主题是"绿水青山,就是金山银山".华雪与同学们积极参加了这一主题的活动,在老师的指导下,他们对一造纸厂排放的污水进行检测,发现其主要的污染物为NaOH.为了测定污水中NaOH的含量,他们首先把溶质质量分数为98%(密度1.84g/cm 3)的浓硫酸20g,稀释为质量分数为10%的硫酸;然后取80g污水于烧杯中,逐滴加入10%的硫酸至49g时恰好完全反应(假定污水中的其它成分不与硫酸反应).请计算:
(1)把20g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是 g.
(2)污水中所含NaOH的质量分数是多少?(写出计算过程)
(3)取80g该污水于烧杯中放置几天后,若其中的氢氧化钠全部转化为碳酸钠.则此时应逐滴加入10%的硫酸 克才能使碳酸钠恰好完全变成硫酸钠.
某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下

请回答下列问题:
(1)滤液可作化肥使用,你认为它属于 肥;
(2)该同学制得氧气的质量 g;
(3)计算滤液中溶质质量分数。
已知:①NaHCO3 固体受热分解 2NaHCO3 Na2CO3+CO2↑+H2O;②Na2CO3 受热不分解。回答下列问题:
(1)关于 NaHCO3 固体的叙述错误的是 (填标号)。
A.俗称小苏打 B.难溶于水
C.可与稀盐酸发生反应 D.是发酵粉的主要成分之一
(2)欲测定某 NaHCO3固体样品(只含Na2CO3杂质且分布均匀)中NaHCO3的质量分数,将 5.0g 该样品加热至质量不再改变,测得剩余固体的质量、生成CO2的质量随时间变化如图所示。
①NaOH溶液的pH 7(填“>”、“=”或“<”),用该溶液将生成的CO2完全吸收,发生反应的化学方程式为 。
②由图中数据可知,上述5.0g NaHCO3 样品完全分解产生CO2的质量为 g,产生H2O的质量是 g。
③计算该样品中NaHCO3的质量分数(根据化学方程式写出完整的计算步骤)。

用溶质质量分数为5%的NaOH溶液中和73g的稀盐酸,反应过程中溶液的酸碱度变化如图所示。请计算
(1)用质量分数为10%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水 克。
(2)当a为80g时,所得溶液中溶质的质量分数是多少(结果精确到0.1%)?

酸、碱、盐在生产和生活中有广泛的应用。
(1)焙制糕点所用发酵粉中含有碳酸氢钠,其俗名为 (填字母代号)。
a.纯碱 b.烧碱 c.苏打 d.小苏打
(2)如图1是氢氧化钠溶液与硫酸反应时溶液pH变化的示意图。
①根据图示判断,该实验是将 (填“氢氧化钠溶液”或“硫酸”)滴加到另一种溶液中。
②滴入溶液体积为V2mL时,溶液中的溶质为 。
(3)为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了如图2方案:

①过滤用到的玻璃仪器有烧杯、玻璃棒和 。
②写出加入Ba(OH)2溶液时反应的化学方程式 。(提示:微溶物不形成沉淀)
③溶液X中含有哪些杂质?请设计实验加以证明 。(简要写出实验步骤和现象)
(4)为测定某石灰石样品中碳酸钙的质量分数,称取10g石灰石(杂质不参加反应)放入烧杯中,加入100g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为106.7g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数。
生活中常见物质的性质、制法的是化学研究的重要内容。
(1)复分解反应发生后,生成物肯定不会是 (填"单质"或"化合物")。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是 。
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液呈红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么?
(4)如图装置可作一氧化碳还原氧化铁的实验,并检验生成的气体产物。

①B装置玻璃管里可观察到的现象为 。
②C装置中反应的化学方程式为 。
③实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案,简要写出实验步骤、现象和结论。(提示:Na 2CO 3溶液呈碱性)
(5)工业上可利用"铝热反应"焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?

向100克MgCl 2和HCl的混合溶液中,逐滴加入10%的氢氧化钠溶液,反应情况,如图所示。
(1)当滴加氢氧化钠溶液的质量至N点时所得溶液的pH值为 (填编号);
A.大于7 B.等于7 C.小于7
(2)通过计算,确定M点的值,写出计算过程。
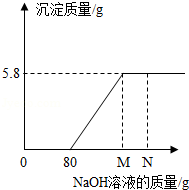
工业盐酸中通常溶有少量的FeCl 3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示,FeCl 3与NaOH反应的化学方程式为FeCl 3+3NaOH═Fe(OH) 3↓+3NaCl.请回答下列问题:
(1)FeCl 3与NaOH恰好完全反应时,生成沉淀的质量是 g。
(2)该工业盐酸中HCl的质量分数是多少?(写出计算过程)
(3)取l00g该工业盐酸稀释成HCl质量分数为10%的稀盐酸,需加多少克水?(写出计算过程)

大理石是含杂质的碳酸钙,因具有美丽花纹而被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。

(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑,杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是 。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克。实验后,根据实验数据绘制了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b分析计算出大理石样品中碳酸钙的质量。
(3)请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数。(结果精确到0.1%)
(4)计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大会对实验结果造成较大影响,其原因是 。
某拓展性学习小组在学校科学实验创新比赛中,做了一个有趣的实验,装置如图。
实验设计:三颈烧瓶中充满二氧化碳气体,A颈、B颈分别连接充满氢氧化钠溶液和盐酸的注射器,C颈插有两端开口的玻璃导管(伸入瓶内的一端连有小气球),装置气密性良好。
实验操作:先通过A颈往瓶内注入氢氧化钠溶液,观察到小气球的形状发生了变化;过一段时间后再通过B颈往瓶中注入盐酸,发现小气球的形状又发生了改变。
请描述小气球形状的变化情况,并对此作出合理的解释。

某学校兴趣小组在参与"五水共治"行动中,考察了某工厂的废水处理工程,并取该厂未经处理的废水样品进行测定分析:
(1)用紫色石蕊试液检验废水的酸碱性,石蕊试液呈 色,说明该废水显酸性.
(2)另取废水样品少量,滴加适量Ba(NO 3) 2,有白色沉淀产生,说明该废水中一定含有的酸根离子是 .
(3)同学们进一步了解到该废水中中含有一种酸,为测定其所含酸的质量分数,取该废水200克于烧杯中,逐渐加入硝酸钡溶液,生成的沉淀质量与加入硝酸钡溶液的质量关系如图所示,请计算废水中硫酸的质量分数.(假设该废水中的其他物质均溶于水且不与硝酸钡溶液反应).

在校园科技节上,为测出鸡蛋壳(主要成分是碳酸钙)中钙元素的质量分数,某同学称取已洗净、晾干、研成粉末的鸡蛋壳10克置于烧杯中,将烧杯放在电子天平上,往烧杯中加入足量的稀盐酸,每0.5分钟记录一次电子天平的示数,据此计算出产生气体的质量,具体数据如表(反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑)
时间(分钟) |
0 |
0.5 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
产生气体质量(克) |
0 |
1.80 |
3.00 |
3.60 |
3.96 |
3.96 |
3.96 |
(1)若产生的气体全部是鸡蛋壳中的碳酸钙与盐酸反应生成的CO2,根据实验结果计算出该鸡蛋壳中钙元素的质量分数。(假定鸡蛋壳中其它成分不含钙元素,写出具体计算过程)
(2)下列哪些情况会导致实验中钙元素质量分数测量结果偏大? (可多选)
A.盐酸溶质质量分数过大 B.鸡蛋壳未晾干 C.鸡蛋壳中含有碳酸镁 D.鸡蛋壳未充分研碎。
我国著名化工专家侯德榜创立了"候氏制碱法",促进了我国民族工业的发展。其生产原理是在氯化钠饱和溶液中通入氨气,再通入二氧化碳,使溶解度较小的碳酸氢钠从溶液中以沉淀的形式析出:
NaCl+NH 3+CO 2+H 2O═NH 4Cl+NaHCO 3↓
过滤出碳酸钠晶体,再受热分解得到产品:2NaHCO 3  Na 2CO 3+H 2O+CO 2↑
Na 2CO 3+H 2O+CO 2↑
(1)"侯氏制碱法"制得的"碱"是 (写化学式);
(2)根据化学方程式计算,5.85吨NaCl可制得8.4吨NaHCO 3,实际上从反应后的混合物溶液中析出NaHCO 3晶体的质量 8.4吨;(选填"大于"、"等于"或"小于")
(3)与"侯氏制碱法"不同的是,比利时科学家苏尔维在制碱过程中,向滤出NaHCO 3晶体后的混合溶液中加熟石灰以回收氨气:2NH 4Cl+Ca(OH) 2  CaCl 2+2NH 3↑+2H 2O
CaCl 2+2NH 3↑+2H 2O
请计算:NH 4Cl质量分数为20%的混合溶液5.35吨,完全反应后理论上可获得NH 3多少吨?
我国拥有地球上7%的耕地,但化肥使用量却占全球总量的35%,认识化肥,科学施肥至关重要。
(1)下列物质中,可用作磷肥的是 :
A.K 2SO 4 B.CO(NH 2) 2 C.KNO 3 D.Ca(H 2PO 4) 2
(2)NH 4Cl是常见的氮肥,不能与碱性物质混用,否则会因释放出 而损失肥效;
(3)过度使用化肥造成的后果有:① ;②水体富营养化等;
(4)"雷雨发庄稼"现象涉及的化学反应较为复杂,其中一个反应是NO 2与H 2O反应生成HNO 3和NO,写出该反应的化学方程式: ;该反应中。化合价发生改变的元素是_ (填元素符号)。
在锥形瓶中加入80.0g质量分数为10%的硫酸铜溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净后在天平上称得质量为56.0g,再将盛有硫酸铜溶液的锥形瓶和铁钉一起放在天平上称量,记录所称得质量m 1.将上述铁钉浸到硫酸铜溶液中,待反应一段时间后溶液颜色改变时,将盛有硫酸铜溶液和锥形瓶放在天平上称量,记录所称的质量为m 2。
(1)m 1 m 2(填">"或"="或"<")。
(2)锥形瓶的质量为 (用含m 1或m 2的代数式表示)。
(3)若硫酸铜反应完全,求此时所得溶液的质量(写出计算结果)。