(11分)小明同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.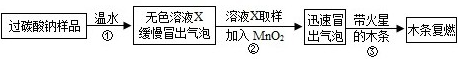
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验.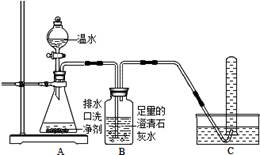
要保证实验的效果,实验装置要有良好的气密性,检查A装置气密性的方法是_________.实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺.由此同学们得出结论:生成的两种气体分别是_______、________(填化学式).
【探究二】
(1)实验过程:教师提供了一瓶过碳酸钠(Na2CO4),
小组同学进行了如下实验探究:
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设:根据以上实验现象,X溶液中一定存在的溶质是 _____;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种.写出上述实验探究中②反应的化学方程式__________.
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3+CaCl2═CaCO3↓+2NaCl
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同.
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验.请将下列实验方案填写完整.
| 实验操作 |
主要实验现象 |
结论 |
| ①____________________ |
_____________ |
证明溶液中有Na2CO3 |
| ②_________________ |
______________ |
证明溶液中既无NaHCO3又无NaOH |
(6)实验反思:①根据资料,Na2CO4与水反应的化学方程式为________________.②Na2CO3、NaHCO3两种物质性质上既有共性又有差异,其差异性可用于鉴别、______等.
FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验。
该实验小组同学通过查阅资料,进行了尝试。
【阅读资料:】
不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。右表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
| |
Fe(OH)3 |
Cu(OH)2 |
| 开始沉淀的pH |
1.9 |
4.7 |
| 沉淀完全的pH |
3.2 |
6.7 |
(1)进行操作x时,应用到的仪器有:铁架台、玻璃棒、烧杯和 。
(2)实验中,步骤b加入CuO消耗溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式 ;你认为步骤b调节溶液的pH到 (填数值范围)比较合适。
(3)实验中,步骤d加稀盐酸前,因缺少 (填操作名称)而使获得的氯化铁溶液不纯。
(4)FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用 (用字母表示)最合理。
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
漂白粉的主要成分为次氯酸钙 [Ca(ClO)2] 和氯化钙,既可用作漂白剂,又可用作消毒剂。漂白粉中有效成分是 [Ca(ClO)2] ,漂白的原理是:Ca(ClO)2在空气中发生反应
Ca(ClO)2+ CO2+ H2O=CaCO3↓+ 2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,易分解生成HCl和一种常见的单质气体。HClO具有漂白性,能使品红等有色物质褪色。
【漂白粉制取的研究】
有人提出可以利用海水(含NaCl)和石灰石为原料制取漂白粉,该方法流程如下:
(1)⑤中的反应是2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2X, X的化学式为______,其中Ca(ClO)2中氯元素的化合价为______.
(2)实际工业生产中,反应⑤的反应物Ca(OH)2最好用 ,(填“饱和石灰水”或“石灰乳”)并不断搅拌。
【定性研究】
有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验。
【提出问题】长时间放置的漂白粉是否变质?
【猜 想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为CaCl2、Ca(ClO)2 CaCO3;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3。
【实验探究】
| 实验操作 |
实验现象 |
实验结论 |
| ① ①取少量样品于试管中, 。 |
有气体产生,气体使石灰水变浑浊。 |
猜想2成立 |
| ② 在上述反应后的试管中加少量 溶液。 |
。 |
【定量研究】
已知漂白粉有效成分能与浓盐酸发生如下反应Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O,某同学通过查阅资料,设计一个最简单的实验,测定漂白粉有效成分的质量分数。
【资料】Cl2能溶于水,但在饱和食盐水中的溶解性非常小。实验条件下Cl2的密度为3.17g/L.
【实验探究】
(3)甲同学准确称取0.5g漂白粉样品,检查装置气密性后装入下图A中,进行实验。实验结束后,量筒内收集到89.6mL食盐水。据此计算,此样品中有效成分的质量分数。(写出计算过程,计算过程中,保留3位小数,结果精确到0.1%)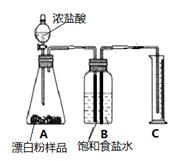
(4)在读取量筒的刻度数时,应注意
①视线与凹液面最低点应齐平;
②装置内气体应恢复至室温;
③__ ____.
(5)实验结束后,同学们发现,此装置存在着明显的不足: (填序号)
A.没有考虑到盐酸占据的体积对测定结果的影响。
B.没有考虑到残留在导管中的液体和导管本身的体积对测定结果的影响。
C.没有考虑到氯气中可能混有的二氧化碳气体对测定结果的影响
D.没有考虑到氯气中可能混有的氯化氢气体对实验结果的影响。
为减少污染、提高煤的利用率,可将其转化为可燃性气体,其微观示意图如下所示:
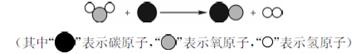 下列说法正确的是
下列说法正确的是
A.图中表示化合物的是 |
| B.该反应类型为化合反应 |
| C.该反应中反应物两种分子的个数比为3∶1 |
| D.反应前后原子的种类和数目保持不变 |
在一定条件下,一个密闭容器中发生某个化学反应,一段时间后,测得有关数据如表,则下列关于此反应认识不正确的是
| 物质 |
R |
氧气 |
二氧化碳 |
水 |
| 反应前质量/g |
4.6 |
x |
0 |
0 |
| 反应后质量/g |
0 |
0 |
8.8 |
5.4 |
A.X等于9.6
B.R一定含C、H两种元素,可能含O元素
C.R中一定含C、H、O三种元素
D.该反应属于氧化反应
在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法正确的是
| 物质 |
A |
B |
C |
D |
| 反应前质量/g |
4 |
6 |
111 |
4 |
| 反应后质量/g |
待测 |
15 |
0 |
84 |
A.该闭容器中发生的化学变化属于分解反应
B.密闭容器中发生的化学变化属于化合反应
C.该反应中A、B、C、D四种物质(参加反应或生成)的质量比为26∶9∶111∶80
D.反应后密闭容器中A的质量为22 g
某有机物R与氧气置于完全密闭的容器中引燃,充分反应后,生成二氧化碳和水。实验测得反应前后的物质质量如下表所示:
| |
R |
O2 |
CO2 |
H2O |
| 反应前质量/g |
51 |
96 |
0 |
0 |
| 反应后质量/g |
a |
0 |
88 |
54 |
下列说法中不正确的是
A.a值为5
B.R物质只含有碳、氢元素
C.R物质中碳、氢质量比为4∶1
D.反应生成二氧化碳和水的分子个数比为2∶3
一定量的木炭在盛有氧气和氮气混气体的密闭容器中燃烧,有关分析正确的是
A、反应前后混合气体中氮气的质量分数不变
B、反应后气体混合物的组成有3种情况
C、若反应后气体是3种气体的混合物,则其中C、O元素的质量比一定小于12:16
D、若反应后气体中有氧气,则容器中C、O元素的质量比大于12:32
在一个密闭容器内有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下:
| 物质 |
X |
Y |
Z |
Q |
| 反应前质量/g |
4 |
10 |
1 |
21 |
| 反应后质量/g |
0 |
12 |
15 |
待测 |
且X的相对分子质量为n,Q的相对分子质量为2n,则下列推理正确的是( )
A.反应物是Y和Z,生成物是X和Q
B.反应后生成15gZ
C.参加反应的Y与Q的质量比是1:1
D.该反应方程式中X与Q的化学计量数比为2:3
把甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应前后各物质的质量如下表,相关分析错误的是
| A、乙可能是催化剂 B、甲、丙是反应物 C、参加反应的甲、丙的质量比为1:2 D、丁一定是化合物 |
物质 |
甲 |
乙 |
丙 |
丁 |
| 反应前质量(g) |
4.0 |
2.0 |
3.0 |
2.0 |
|
| 反应后质量(g) |
1.2 |
x |
2.4 |
5.4 |
|
| |
|
|
|
|
在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如表.下列说法中不正确的是( )
| 物质 |
甲 |
乙 |
丙 |
丁 |
| 反应前物质质量/g |
8 |
32 |
5 |
4 |
| 反应后物质质量/g |
16 |
4 |
x |
24 |
A.该反应为分解反应
B.丙可能为该反应的催化剂
C.甲、乙两种物质间参加反应的质量比为1:4
D.乙、丁两种物质间反应的质量比为7:5
为了测定液化气中丙烷(C3H8)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表
| 物质 |
丙烷 |
氧气 |
水 |
二氧化碳 |
X |
| 反应前质量/g |
4.4 |
12.8 |
0 |
0 |
0 |
| 反应后质量/g |
0 |
0 |
7.2 |
4.4 |
a |
下列判断正确的是
A.X可能含有氢元素 B.X可能是该反应的催化剂
C.表中a的值为5.6 D.X只含碳元素
将一定量的乙醇(C2H5OH)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:( )
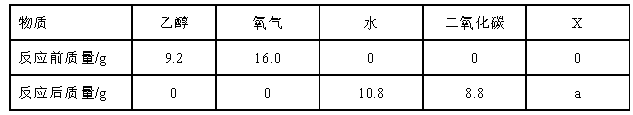
| A.无论如何改变氧气的起始量,均有X 生成 |
| B.X 一定是该反应的催化剂 |
| C.X 不含氢元素 |
| D.表中a 的值为6.6 |
在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表。下列说法正确的是
| 物质 |
A |
B |
C |
D |
| 反应前质量/g |
4 |
6 |
111 |
4 |
| 反应后质量/g |
待测 |
15 |
0 |
84 |
A.该闭容器中发生的化学变化属于分解反应
B.密闭容器中发生的化学变化属于化合反应
C.该反应中A、B、C、D四种物质(参加反应或生成)的质量比为26∶15∶111∶80
D.反应后密闭容器中待测A的质量为22 g
在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示,下列说法中正确的是
| A.该反应为化合反应 |
| B.丙一定为该反应的催化剂 |
| C.该反应中,乙、丁的质量变化之比为5:7 |
| D.该反应中,甲、乙的质量变化之比为1:4 |