(15分)兴趣小组分析了用硫铁矿烧渣(主要成份Fe203、Fe304、FeO等)制备铁红(Fe2O3) 的流程图并进行了铁红性质实验。
一、铁红制备的流程图分析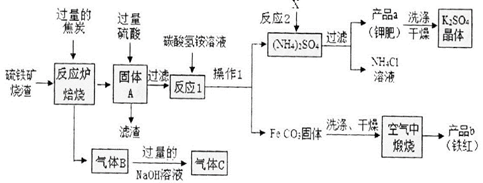
(1)写出焙烧中CO与Fe203反应的化学方程式_ 。
(2)实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒 和_ (填仪器名称)
(3)你认为对气体C最佳的处理方法 是_ 。
A.冷却后排入空气 B.燃烧后排放 C.再通入反应炉
(4)反应1的反应温度一般需控制在35℃以下,其目的是_ 。
(5)反应2中相关物质的溶解度如下表。你认为该反应在常温下能实现的原因是 。
洗涤干燥得到K2S04晶体时,可选用下列__ (填字母)洗涤剂;
A.KCl的饱和溶液 B.水 C.K2S04的饱和溶液
为检验K2S04晶体是否洗涤干净,可取最后一次洗涤液,先加入_ (选填序号,下同),
振荡、静置,再向上层清液中滴加_ ,观察现象即可判断。
A.AgN03溶液 B.过量的BaCl2溶液 C.过量的Ba(N03)2溶液
二、铁红的性质实验
【问题讨论】
【资料1】草酸晶体(H2C204·3H20)在浓H2S04作用下受热分解,化学方程式为:
H2C2O4·3H2O C02↑+C0↑+4H20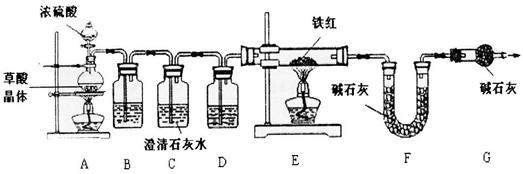
(6)实验前应先_ 。
(7)进入E中的气体是纯净、干燥的CO,则B、D中的试剂依次是__ 、___ (填字母编号)。
A.浓硫酸 B.澄清的石灰水 C.氢氧化钠溶液
(8)C装置的作用是 。
【数据分析与计算】
用SDTQ600热分析仪对氧化铁(Fe2O3)和CO进行热反应分析,获得相关数据,绘制成管内剩余固体质量〜反应温度的关系如下图。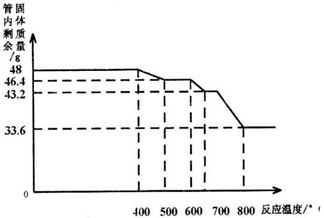
【资料2】已知铁的氧化物有:FeO、Fe304、Fe2O3,在一定的条件下,均能够逐步失去其中的氧,最终被还原为铁。
(9)800℃以上时,管内固体成分的化学式为 ;
(10)写出管内固体质量由48g变为46.4g时反应的化学方程式_ 。
【实验评价】
请指出【问题讨论】中实验装置的一个明显缺陷 。
2012年4月15日,央视《每周质量报告》对“非法厂商用皮革下脚料造药用胶囊”曝光,其制成的胶囊往往重金属铬超标。
(1)重金属的毒性主要是由于它与人体内酶的—SH基结合而产生。误食重金属盐后,可尽快喝适量牛奶或鸡蛋清解毒。牛奶和鸡蛋清富含的营养素是______________。
(2)下图是铬元素在周期表中的一格,你能从该图的数字得到的信息有:_____________(写一条)。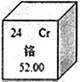
(3)铬是银白色有光泽且硬而脆的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。人们通常在自行车车圈、水龙头等表面镀一层铬,是为了_________。
(4)铬的化合物可用于检测是否酒后驾车,其原理为遇到酒精红色的CrO3转变为绿色的Cr2(SO4)3,在Cr2(SO4)3中铬元素的化合价为___________________。
某钢铁厂高炉炼铁的主要原料是焦炭、赤铁矿(主要成分为Fe2O3)、空气等,主要反应过程如下图所示: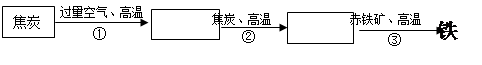
写出②③两步反应的化学方程式。
② ▲ ;
③ ▲ 。
矿物储量有限,而且不可再生。根据已探明的一些矿物的储藏量,并根据目前这些金属和消耗速度科学家初步估计一些矿物可开采年限如下图所示: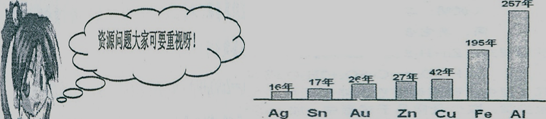
(1) 请你联系实际,作为时代的主人,看了上图后,想一想你有哪些感悟
______________________________________________________________
(2)你提出一条节约资源的建议:
_______________________________________________________________