金属在生产和生活中有广泛的应用。
(1)铁在潮湿的空气中易生锈的原因是 。
(2)向硝酸银溶液中加入一定量的锌和铜的混合粉末,充分反应后过滤,滤液呈蓝色,则滤出的固体中一定含有 ;滤液中一定含有的金属离子是 (写离子符号)。
(3)某同学称取黄铜(铜锌合金)样品20g放入锥形瓶中,向其中加入100g稀硫酸恰好完全反应,测得反应后剩余物的质量为119.8g,则所用稀硫酸中溶质的质量分数为 。
金属和金属材料在日常生活中有广泛用途.请回答下列问题:
(1)地壳中含量最高的金属元素是 (填元素符号).
(2)现有甲、乙、丙三种金属,如果把甲和乙分别放入稀硫酸中,甲溶解并产生氢气,乙不反应;如果把乙和丙分别放入硝酸银溶液中,过一会儿,在乙表面有银析出,而丙没有变化.根据以上实验事实,判断甲、乙、丙的金属活动性由强到弱的顺序是 .
(3)铜丝浸入硝酸银溶液中,可发生反应:Cu+2AgNO3=Cu( NO3)2+2Ag,该反应属于四种基本反应类型中的 反应.
某化学兴趣小组的同学想从含有Al 2(SO 4) 3、CuSO 4的废液中回收金属铜,设计流程如图:

(1)过滤操作中用到的所有玻璃仪器为 。
(2)Ⅰ中有关反应的化学方程式 。
(3)溶液B中所含的溶质是 ;固体A的成分是 。(均填化学式)
(4)Ⅱ中加入过量的稀硫酸的目的是 。
根据国家发改委的项目规划,经过我市的高铁将于2016年开工建设,在高铁建设中要用到许多金属材料。
(1)施工过程遇到雷电天气,要远离铁塔以防雷击,是因为铁具有 性。
(2)铺设高铁的轨道材料不用纯铁而用合金钢,这是因为合金钢的硬度比纯铁的 大 。车体表面喷漆可有效防止铁与水、 接触而生锈。
(3)在铝、铜、银三种金属中,最容易被氧化的是 。探究铝、铜、银的活动性顺序,除铝、铜、银外,还需用的一种试剂是 溶液。
金属在生产、生活中应用广泛,金属的回收利用有利于保护环境、节约资源。
(1)用体温计测量体温时,水银柱会上升。用微观知识解释产生该现象的原因 。
(2)我国古代典籍中有“银针验毒”的记载。“银针验毒”的反应原理之一是:4Ag+2H2S+O2═2X+2H2O,X的化学式为 。
(3)某工厂欲从溶质是AgNO3和Cu(NO3)2的生产废液中回收Ag和Cu.实验员取样,向其中加入一定量的锌,充分反应后过滤,得到滤渣和滤液。
①若所得滤液为蓝色,则滤液中一定含有金属离子 (填离子符号)。
②若向所得滤渣中加入一定量稀硫酸产生气泡,则滤渣中一定含有 。
废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。

已知:Sn+SnCl 4═2SnCl 2
(1)SnCl 4中锡元素的化合价是 。
(2)铜的金属活动性比锡的 (填"强"或"弱"),固体A中一定含有的金属元素是 。
(3)写出步骤②发生反应的化学方程式 。
(4)相比于直接焚烧废旧电路板回收金属,该工艺主要优点是 (回答一点即可)。
金属材料在人类的生产、生活中有着十分重要的作用。
(1)多种金属可以压成薄片,抽成细丝,说明金属具有 性。
(2)实验室有打磨过的铝片、铁片和硫酸铜溶液。兴趣小组同学欲验证铝、铁和铜的活泼性顺序,进行如下操作:
①取少量硫酸铜溶液于试管A中,将铁片(足量)插入硫酸铜溶液中,充分反应后将铁片取出,观察到的实验现象是 。
② (请补充实验具体操作)。
③取少量硫酸铜溶液于试管B中,将铝片插入硫酸铜溶液中,充分反应,写出该反应的化学方程式 。
结论:三种金属的活泼性由强到弱顺序是 。
(3)金属腐蚀造成的损失巨大,对金属腐蚀的控制尤为重要。下列对金属的防护措施不合理的是 (填序号)。
a、齿轮表面涂油 b、将钢材深埋保存
c、将钢刀浸泡在盐水中 d、车圈镀铬。
金属在生活中随处可见。请回答下列问题。
(1)"一角"硬币的材料是铝合金。合金属于 (填"纯净物"或"混合物"),制造合金硬币不需要考虑的性质是 (填字母序号)。
| A. |
光泽好 |
| B. |
耐腐蚀 |
| C. |
能导电 |
(2)生活中铁制品比铜制品更容易锈蚀,这说明铁的金属活动性比铜 (填"强"或"弱")。将表面光洁的铁钉放入稀硫酸中会有气泡产生,该反应的化学方程式是 。
(3)下列做法不利于有效保护金属资源的是 (填字母序号)。
| A. |
回收废旧金属制品 |
| B. |
寻找金属的替代品 |
| C. |
加速开采矿物资源 |
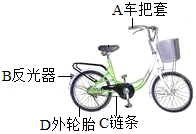
如图是人们经常使用的便捷交通工具﹣﹣自行车。请回答下列问题:
(1)所标各部件中由金属材料制成的是 (填字母),属于有机合成材料的有 (任选一种部件填字母)。
(2)生铁和钢都是铁的合金,其性能不同的原因是 。
(3)金属矿物储量有限,不可再生。保护金属资源的有效途径,除了防止金属锈蚀外,还有 (写一条即可)。
(4)将一定量的铝、铜粉末混合物加入硝酸银溶液中,充分反应后过滤,滤液为蓝色。则滤渣中一定含有 (填化学式),滤液中溶质的组成可能是 (填化学式)。
金属在生活、生产中有着广泛的应用,种类繁多的金属材料已成为社会发展的重要物质基础。
(1)实验室所用的石棉网中有铁丝,隔着石棉网给容器加热可达到均匀受热的目的,这主要利用了铁的 性。石棉网使用一段时间后,其中的铁丝容易生锈,可用稀盐酸除去,其化学方程式可表示为 。
(2)某化学兴趣小组将一定质量的Fe和Zn的混合粉末加入AgNO3溶液中,充分反应后过滤,得到滤渣和滤液:
①如果滤液呈无色,则滤渣中一定含有的金属是 ;
②如果滤液中加入稀盐酸有白色沉淀,则滤液中的金属阳离子有 种;
③如果滤液呈浅绿色,则关于该滤渣和滤液的下列说法中正确的是 。
A.向滤渣中加入稀盐酸,一定有气泡产生
B.向滤液中加入稀盐酸,一定有白色沉淀产生
C.滤渣中一定含有Ag
D.滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Zn(NO3)2
Ⅰ.建立"宏观﹣微观"之间的联系,是化学学习的重要方法。根据图示回答下列问题:
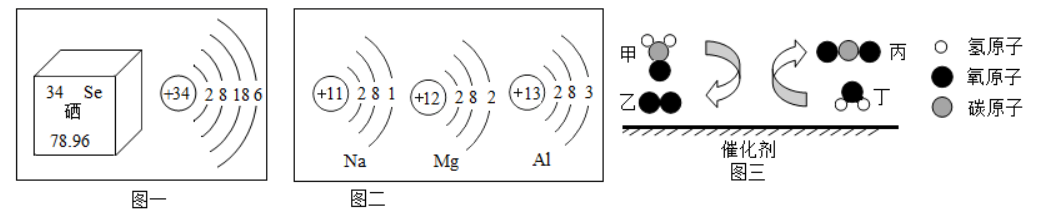
(1)硒元素被科学家称为"抗癌之王",科学界研究发现血硒水平的高低与癌的发生息息相关。图一是硒元素的相关信息:硒原子在化学变化中易 电子(填"得到"或"失去")。硒元素的相对原子质量是 。
(2)由图二可知:在元素周期表中,钠、镁、铝元素位于同一周期,是因为它们具有相同的 。
(3)科学家发现,利用催化剂可有效消除室内装修材料释放的有害气体甲醛(HCHO)。请根据图三写出反应的化学方程式 。
Ⅱ.人们在实验研究中总结出常见金属的活动性顺序:

(4)请在表中  内填写对应的元素符号 。
内填写对应的元素符号 。
(5)Mg、Sn、Pb、Cu、Ag五种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有
种。
将一定质量的铁粉和铜粉加入到Zn(NO3)2和AgNO3的混合溶液中,一定会发生的化学反应方程式为 。充分反应后过滤,向滤渣中滴加稀盐酸,有无色气体产生,则滤渣中一定含有 (填化学式),滤液中的溶质一定含有 (填化学式)。
镁是一种常见的金属,请回答下列问题。
(1)组成和结构:
①从宏观看,镁是由 组成的。
②从微观看,据如图分析,镁位于元素周期表中第 周期,在化学反应中容易 (填“得到”或“失去”)电子形成镁离子。
(2)性质和变化:
①镁具有可燃性,在空气中燃烧的化学方程式是 。
②向镁条中滴加稀盐酸,产生大量气泡,此反应是一个 (填“放热”或“吸热”)反应。
③把一定量的镁放入硝酸铜和硝酸银的混合溶液中,充分反应后过滤,滤液为无色,则滤液中的溶质是 (填化学式,下同),滤渣的组成可能是 。
