金属在生活、生产中有着广泛的应用,种类繁多的金属材料已成为社会发展的重要物质基础。
(1)实验室所用的石棉网中有铁丝,隔着石棉网给容器加热可达到均匀受热的目的,这主要利用了铁的 性。石棉网使用一段时间后,其中的铁丝容易生锈,可用稀盐酸除去,其化学方程式可表示为 。
(2)某化学兴趣小组将一定质量的Fe和Zn的混合粉末加入AgNO3溶液中,充分反应后过滤,得到滤渣和滤液:
①如果滤液呈无色,则滤渣中一定含有的金属是 ;
②如果滤液中加入稀盐酸有白色沉淀,则滤液中的金属阳离子有 种;
③如果滤液呈浅绿色,则关于该滤渣和滤液的下列说法中正确的是 。
A.向滤渣中加入稀盐酸,一定有气泡产生
B.向滤液中加入稀盐酸,一定有白色沉淀产生
C.滤渣中一定含有Ag
D.滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Zn(NO3)2
2021年3月,四川三星堆遗址进行了新一轮考古发掘。至今三星堆已出土了黄金面具、青铜纵目面具等一批珍贵文物,如图。
(1)出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜
(选填"强"或"弱")。
(2)古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜(CuFeS 2),其中铁元素和铜元素均为+2价,则硫元素的化合价为 。
(3)应用碳﹣14测出三星堆遗址距今3000年左右,碳﹣12和碳﹣14是碳元素的两种同位素原子,它们的主要区别是原子核中 数不同。

人类对科学规律的认识常需经历漫长的探索过程,对金属活动性规律的认识也是如此。
(1)1625年格劳贝尔发现将金属放入稀盐酸中会"消失",这为发现金属活动性顺序奠定了基础,小嘉选用锡、铜、锌三种金属重温实验,则会"消失"的金属有 。
(2)1766年卡文迪许用金属与酸反应制取了一种可燃性气体,他称之为"可燃空气",其实该气体就是 。从此为探索金属活动性打开了新思路。
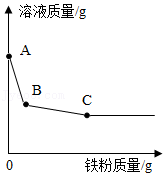
(3)1865年贝开托夫经过大量的实验得出了金属活动性规律。小嘉运用该规律开展实验,向硝酸铜和硝酸银的混合溶液中逐渐加入铁粉,溶液质量变化如图所示,则B点时溶液中所含的金属阳离子有 。
“宏观一微观一符号”三重表征是化学独有的表示物质及其变化的方法。请结合图示回答下列问题。

(1)实验a中,金属R表面有银白色固体物质析出,实验b中,锌表面有黑色固体物质析出。比较R、Zn、Ag的活动性强弱 。
(2)图c是实验a中反应的微观示意图,根据图c分析实验a中溶液增加的离子
是 ,减少的离子是 (填离子符号)。
(3)写出实验a中发生的化学反应方程式 (用含R的符号表示),该反应类型为 。
金属在生产、生活和社会发展中应用较为广泛,中国制造,让世界瞩目!
(1)航天:我国用长征三号乙运载火箭成功发射第55颗北斗导航卫星,化学材料在其中起到了重要作用,铝合金和钛合金被广泛用于航天工业、一般情况下,铝合金的强度和硬度比纯铝 (填“高”或“低”)。
(2)交通:制造港珠澳大桥需要大量的钢铁,请写出一种防止钢铁生锈的方法: 。
(3)冶炼:我国湿法炼铜很早就有记载,东汉《神农本草经》曾记载石胆“能化铁为铜”。向硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,充分反应后过滤,滤液呈蓝色,则滤出的滤液中一定含有金属离子是 。
(4)应用:随州编钟被誉为“世界第八大奇迹”,代表了我国古代青铜工艺的较高水平,青铜是铜锌合金。现有铜锌合金质量20克,与100克质量分数为19.6%的稀硫酸恰好完全反应,则铜锌合金中铜的质量分数为 。
Ⅰ.建立"宏观﹣微观"之间的联系,是化学学习的重要方法。根据图示回答下列问题:
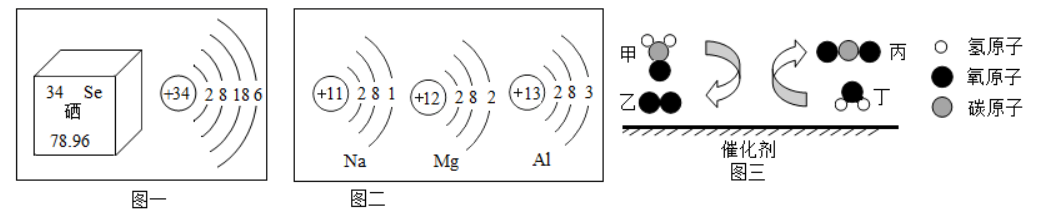
(1)硒元素被科学家称为"抗癌之王",科学界研究发现血硒水平的高低与癌的发生息息相关。图一是硒元素的相关信息:硒原子在化学变化中易 电子(填"得到"或"失去")。硒元素的相对原子质量是 。
(2)由图二可知:在元素周期表中,钠、镁、铝元素位于同一周期,是因为它们具有相同的 。
(3)科学家发现,利用催化剂可有效消除室内装修材料释放的有害气体甲醛(HCHO)。请根据图三写出反应的化学方程式 。
Ⅱ.人们在实验研究中总结出常见金属的活动性顺序:

(4)请在表中  内填写对应的元素符号 。
内填写对应的元素符号 。
(5)Mg、Sn、Pb、Cu、Ag五种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有
种。
人类文明进步与金属材料发展关系十分密切。回答下列问题。
(1)元素在自然界分布并不均匀,按质量计算,地壳中含量最多的金属元素是 (填符号)。
(2)钢铁是应用最普遍的金属材料,某些铁制零件防锈措施是涂油,其防锈原理为 。
(3)《吕氏春秋》记载“金柔锡柔,合两柔则刚(即坚硬)”【注:金指铜单质,锡指锡单质】。这句话说明铜锡合金具有的特性是 (填字母)。
a.合金的熔点一般比其组分低
b.合金的硬度一般比其组分大
c.合金的抗腐蚀性一般比其组分强
(4)向硝酸银和硝酸锌的混合溶液中加入一定量的铜粉,观察到溶液由无色变为蓝色后,对混合溶液进行过滤,则滤液中一定含有的溶质是 。
小雨同学为验证镁、铁、锌三种金属的活动性,进行了如图所示实验:
①实验中,小雨观察到的现象是 ,由此得出三种金属的活动性:镁>锌>铁;
②小明还补充了铁片与硫酸铜溶液反应的实验,实验中观察到的现象是 ,有关反应的化学方程式为 。由此得出铁、铜两种金属的活动性:铁 铜(填“>”“=”“<”)。

金属制品与我们的日常生活密不可分。
(1)有铝、锌、铜三种金属,其中不能与稀硫酸发生反应的是 。
(2)铝的化学性质比较活泼,但铝制品具有很好的抗腐蚀性能,其原因是铝表面容易形成 。
(3)为验证Zn、Cu、Ag三种金属的活动性强弱,某同学选用如下试剂组进行验证,其中不合理的一组是 。(用序号①②③填空)
①Zn、CuSO4溶液、Ag
②ZnSO4溶液、Cu、AgNO3溶液
③Zn、Cu、AgNO3溶液
(4)由所学知识可知,活泼性Fe>Cu,Fe+CuSO4═FeSO4+Cu.非金属与金属类似,活泼性Cl2>Br2>I2,请写出将Cl2通入NaBr溶液中发生反应的化学方程式 。
将一定质量的铁粉和铜粉加入到Zn(NO3)2和AgNO3的混合溶液中,一定会发生的化学反应方程式为 。充分反应后过滤,向滤渣中滴加稀盐酸,有无色气体产生,则滤渣中一定含有 (填化学式),滤液中的溶质一定含有 (填化学式)。
金属在生产、生活中应用广泛,金属的回收利用有利于保护环境、节约资源。
(1)用体温计测量体温时,水银柱会上升。用微观知识解释产生该现象的原因 。
(2)我国古代典籍中有“银针验毒”的记载。“银针验毒”的反应原理之一是:4Ag+2H2S+O2═2X+2H2O,X的化学式为 。
(3)某工厂欲从溶质是AgNO3和Cu(NO3)2的生产废液中回收Ag和Cu.实验员取样,向其中加入一定量的锌,充分反应后过滤,得到滤渣和滤液。
①若所得滤液为蓝色,则滤液中一定含有金属离子 (填离子符号)。
②若向所得滤渣中加入一定量稀硫酸产生气泡,则滤渣中一定含有 。
化学研究物质的性质、结构及变化规律。
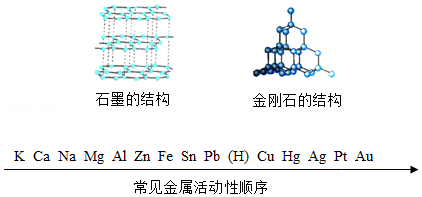
根据所给信息,回答下列问题:
(1)石墨可用作电极,是利用其具有良好的 。资料表明:石墨在一定条件下可以转化为金刚石,从结构上分析,这一转化中发生改变的是 。
(2)Na、Ag、Zn的金属活动性由强到弱的顺序是 。
(3)"真金不怕火炼"的化学原理: 。
(4)某化学小组设计的以下两个方案,均能除去铜屑中的少量铁屑。①加适量CuSO 4溶液,搅拌、过滤、洗涤;②加适量稀硫酸,搅拌、过滤、洗涤。请从中选出你认为最佳的方案,写出该方案中发生反应的化学方程式: ,简要评价该方案的优点: 。
金属材料广泛应用于现代社会中。请用相关的知识回答下列问题。
(1)在日常生活、工农业生产和科学研究中,大量使用的是合金。生铁和 就是含碳量不同的两种铁合金。
(2)日常生活中,菜刀一般采用的防锈措施是 。菜刀用铁制而不用铝制的原因是 。
(3)很多金属都能与氧气反应,写出镁在空气中燃烧的化学方程式 。
(4)现有甲、乙、丙、丁四种金属,丁在自然界中只能以单质形式存在,用甲制的容器不能盛放乙的盐溶液,用丙制的容器却可以盛放乙的盐溶液。由此推断四种金属的活动性由强到弱的顺序是 。
人类社会的发展离不开金属。
(1)黄铜和纯铜,硬度较小的是 。
(2)生活中的铝制品都很耐腐蚀,原因是 (用化学方程式回答)。
(3)某工厂废液中含有硝酸银、硝酸铜,取一定量的该废液样品,加入一定量的锌,充分反应后得到滤液和滤渣,请回答下列问题:
①若滤渣中有Zn,则滤渣中除有Zn外,还一定含有 。
②若滤渣中有Cu,则滤液中的溶质一定含有 ,可能含有 。
纽扣电池是生活中常用的电源,如图是银锌纽扣电池的构造示意图,回答下列问题。
(1)纽扣电池的外壳可以加工得很薄,说明金属具有 性。
(2)氧化银加热分解可以得到两种单质,其化学反应方程式为 。
(3)该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是 ,为了验证该结论,某同学向质量、外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是 (填序号)。
A.银表面没有气泡生成
B.铁表面最终生成气体的总量比锌多
C.铁表面产生气泡的速率比锌慢
