小雨同学为验证镁、铁、锌三种金属的活动性,进行了如图所示实验:
①实验中,小雨观察到的现象是 ,由此得出三种金属的活动性:镁>锌>铁;
②小明还补充了铁片与硫酸铜溶液反应的实验,实验中观察到的现象是 ,有关反应的化学方程式为 。由此得出铁、铜两种金属的活动性:铁 铜(填“>”“=”“<”)。
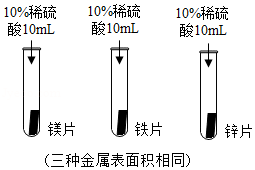
小雨同学为验证镁、铁、锌三种金属的活动性,进行了如图所示实验:
①实验中,小雨观察到的现象是 ,由此得出三种金属的活动性:镁>锌>铁;
②小明还补充了铁片与硫酸铜溶液反应的实验,实验中观察到的现象是 ,有关反应的化学方程式为 。由此得出铁、铜两种金属的活动性:铁 铜(填“>”“=”“<”)。
