实验室常用溶质质量分数为10%的过氧化氢溶液制取氧气。
(1)某兴趣小组打算用如图所示的整瓶溶液配制溶质质量分数为10%的过氧化氢溶液,需加水 g。
(2)在配制过程中,他们发现试剂瓶内壁附着不少气泡,由此推断该瓶过氧化氢溶液的溶质质量分数小于30%,依据是 。
(3)为测定该瓶溶液的溶质质量分数,他们取35g该溶液放入锥形瓶中并加入一定量的二氧化锰。不同时间电子秤的读数如下表所示(不考虑H2O逸出):
|
反应时间/min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
锥形瓶+瓶内物质的总质量/g |
340.00 |
338.78 |
335.64 |
335.28 |
335.20 |
335.20 |
335.20 |
请回答:
①反应生成氧气的总质量为 g。
②该瓶过氧化氢溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)

我市沿海地区大量养殖贝类海产品,贝壳中含有的碳酸钙是重要的工业原料。为了测定某种贝壳中碳酸钙的含量,取贝壳样品25.0g放入烧杯中,分五次加入稀盐酸,每次充分反应后称量(杂质不与稀盐酸反应),所加入稀盐酸的质量与烧杯中物质的质量的关系如下表:
|
加入稀盐酸的总质量(g) |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
|
烧杯中物质的总质量(g) |
47.8 |
70.6 |
93.4 |
116.2 |
141.2 |
计算:
(1)当加入盐酸的总质量为50.0g时,充分反应后生成的气体质量是 g。
(2)该贝壳样品中碳酸钙的质量分数。
现有碳酸钾和氯化钾的固体混合物15.8g,将88.6g稀盐酸加入到固体混合物中,恰好完全反应,得到100g溶液。请计算:
(1)反应生成的气体的质量为 。
(2)混合固体中碳酸钾的质量为 。
(3)计算反应后溶液中溶质的质量分数。(写出计算过程)有
小黄同学为了测定某Cu﹣Ag合金中各金属的含量,取这种合金4.8 g与AgNO3溶液反应,加入AgNO3溶液的质量m与充分反应后所得固体的质量b的关系如图所示.请计算:
(1)AgNO3溶液中溶质的质量分数(结果精确 至0.1%);
(2)该合金中银和铜的质量比(结果精确至0.1).

某造纸厂排放含NaOH的废水200吨,恰好需要含溶质4.9吨的硫酸溶液中和处理,求该废水中NaOH的溶质质量分数。
大理石是含杂质的碳酸钙,因具有美丽花纹而被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。

(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑,杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是 。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克。实验后,根据实验数据绘制了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b分析计算出大理石样品中碳酸钙的质量。
(3)请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数。(结果精确到0.1%)
(4)计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大会对实验结果造成较大影响,其原因是 。
我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了杰出贡献。在实际生产的产品碳酸钠中会混有少量的氯化钠。现有纯碱样品,为测定该样品中碳酸钠的质量分数,已称取样品6g,放入40g水中使其完全溶解,再加入稀盐酸26.2g,恰好完全反应,气体全部逸出,得到氯化钠的不饱和溶液70g。请计算(写出简要的计算过程):
(1)生成二氧化碳的质量。
(2)样品中碳酸钠的质量。
(3)反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
洁厕灵是常用的陶瓷清洗液,小彭同学对某品牌洁厕灵的有效成分及其含量进行研究。
(1)查阅资料得知:洁厕灵有效成分是HCl.HCl的含量可通过已知溶质质量分数的NaHCO 3溶液来测定,其它成分均不参与反应。请完成HCl与NaHCO 3反应的化学方程式:HCl+NaHCO 3=NaCl+ +CO 2↑。
(2)配制一定溶质质量分数的NaHCO 3溶液,需要用到的玻璃仪器有烧杯、滴管和 。
(3)向一锥形瓶中加入100克该品牌的洁厕灵,再逐次加入相同质量分数的 NaHCO 3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
|
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
|
加入NaHCO 3溶液的质量/g |
40 |
40 |
40 |
40 |
40 |
|
反应后溶液的总质量/g |
138.9 |
177.8 |
216.7 |
255.6 |
295.6 |
试分析计算下列问题:
①第一次实验时,所加 NaHCO 3溶液中溶质质量是多少克?
②该品牌洁厕灵中HCl的质量分数是多少?
向147克稀硫酸中加入锌粉(仅含不容于酸的杂质),所加锌粉的质量与产生气体的质量关系如图所示。求:
(1)此过程中产生气体的最大质量是 g。
(2)原稀硫酸中溶质的质量分数。(写出计算过程)

某市售某浓盐酸试剂瓶标签上的有关数据如图1所示。小张同学取5mL该浓盐酸加入锥形瓶中,加水稀释后,再逐滴滴加溶质质量分数为5%的NaOH溶液,反应过程中溶液的酸碱度变化如图2所示。
(1)小张同学所取的5mL浓盐酸的质量为 克。
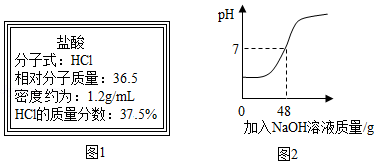
(2)通过计算,判断该浓盐酸中HCl的质量分数是否与试剂瓶标签上的数据相符(需要计算过程,计算结果精确到0.1%)
为测定某黄铜(铜、锌合金)中铜的质量分数,某同学取20g黄铜样品放入盛有200g稀硫酸的烧杯中,恰好完全反应(铜与稀硫酸不反应),测得烧杯中剩余物质的总质量为219.8g,试计算:
(1)生成氢气的质量 g.
(2)该黄铜样品中铜的质量分数,所用稀硫酸的溶质质量分数.(写出计算过程)
徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
|
稀盐酸的用量 |
剩余固体的质量 |
|
第一次加入10g |
3.0g |
|
第二次加入10g |
2.0g |
|
第三次加入10g |
l.0g |
|
笫四次加入10g |
0.6g |
请计算:
(1)4.0g石灰石样品中碳酸钙的质量是 g。
(2)10g稀盐酸能与 g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1% )。
氯可形成多种含氯酸盐,广泛应用于杀菌、消毒及化工领域。实验室中制备KClO3的化学反应方程式为3Cl2+6KOH 5KCl+KClO3+3H2O。若用Cl2与200g的KOH溶液恰好完全反应,反应后溶液质量为221.3g。计算:
5KCl+KClO3+3H2O。若用Cl2与200g的KOH溶液恰好完全反应,反应后溶液质量为221.3g。计算:
(1)参加反应的氯气的质量为 g。
(2)所用KOH溶液中溶质的质量分数是多少?
小明用石灰石测定某稀盐酸中溶质的质量分数,向盛有100g稀盐酸的烧杯中依次加入石灰石粉末(杂质不参加反应),充分反应后,记录实验数据见下表。请计算:
|
实验次数 |
第一次 |
第二次 |
|
石灰石粉末质量/g |
15 |
15 |
|
烧杯中物质总质量/g |
109.5 |
121.2 |
(1)共生成二氧化碳 g。
(2)所用稀盐酸中溶质的质量分数。
我市锰矿资源丰富,MnO 2是一种无机功能材料,主要用于制造干电池。某校课外活动小组同学得到当地某粗MnO 2样品(主要含有杂质MnCO 3,其它杂质忽略不计),为了测定此样品中MnO 2的含量,把100g粗MnO 2样品放入烧杯中,将40g稀硫酸分4次加入与之充分反应,测得的数据如下表。
|
次数 |
1 |
2 |
3 |
4 |
|
加入稀硫酸的质量(g) |
10 |
10 |
10 |
10 |
|
剩余固体质量(g) |
94.25 |
88.5 |
82.75 |
78.2 |
(已知烧杯中发生的反应为:MnCO 3+H 2SO 4═MnSO 4+H 2O+CO 2↑)
请根据图表数据回答下列问题:
(1)样品中杂质的质量是多少?
(2)该样品中MnO 2的质量分数是多少?
(3)稀硫酸中溶质的质量分数是多少?