请用“﹤”、“﹥”或“﹦”填空。
(1)相同条件下在水中的溶解性:氢氧化钙 氢氧化钠;
(2)含碳量:生铁 钢;
(3)pH:硫酸溶液 氢氧化钠溶液;
(4)氢原子核内质子数 氢原子核外电子数。
下图是甲、乙、丙三种固体的溶解度曲线,试回答:
(1)t3℃时,甲、乙、丙三种物质溶解度的大小关系是 。
(2)t3℃时,若将50g的甲、乙两种物质分别加入到100g水中,
充分溶解后,所得的溶液在溶解度曲线图中可表示为 (“A”、“B”或“C”)点,若将甲溶液降温至t1℃,溶液的变化情况是 。
I.溶液变为饱和 Ⅱ.溶解度增加 Ⅲ.溶质减少 Ⅳ.溶质的质量分数不变
如图是A、B、C三种固体物质的溶解度曲线。
(1)P点的含义: ;
(2)当温度为t2℃时,A、B、C三种物质的溶解度由小到大的顺序 。
(3)将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数由大到小的顺序为 。
(4)当A中含有少量B时,为了得到纯净的A,可采用 的方法。
如图是a、b两种固体物质的溶解度曲线。试回答:
(1)t ℃时,两物质溶解度大小关系为a b(填“>”“<”或“=”);
(2)当a中含有少量b时,可以用 法提纯a;
(3)在 ℃时,a、b的溶解度相等,此温度下所得溶液中溶质的质量分数最大为 。
如图是甲、乙两种物质的溶解度曲线,请结合图回答问题:
1) ℃时,甲、乙两种物质的溶解度相等。
2)溶解度随温度升高而降低的物质是 (填“甲”或“乙”)。
3)可使甲物质从其饱和溶液中结晶析出的方法是 。
4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数 乙溶液的溶质质量分数。(填“大于”“等于”或“小于”)。
5)小明同学用甲物质进行以下实验:
①实验过程中,B、C、D对应的溶液为不饱和溶液的是 。
②向B对应的溶液中再加入30 g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因是 。
如图为甲、乙、丙三种不含结晶水的固体物质溶解度曲线,据图回答:
(1)t1℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是 。
(2)t2℃时,将25g甲固体放入30g水中,充分搅拌,所得溶液的溶质质量分数是 %。
(3)t3℃时,将三种物质各mg分别加入100g水中,充分溶解后,只有一种能形成饱和溶液,则m的取值范围是 。
(4)将t1℃时甲、乙、丙三种物质的饱和溶液升温至t3℃,溶质质量分数最大的物质是 。
下表是
、
在不同温度下的溶解度(单位:g/100g水)
| 温度 (℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
|
13.3 |
20.9 |
32 |
45.8 |
64 |
85.5 |
110 |
138 |
169 |
202 |
246 |
| 35.7 |
35.8 |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
①以上两种物质溶解度的变化受温度影响较小的是。
②30℃时,
的溶解度是g/100g水。
③
溶液中含有少量
时,可通过的方法提纯。
④对③析出的晶体和剩余溶液描述正确的是(填写编号)。
Ⅰ.剩余溶液一定是
饱和溶液
Ⅱ.剩余溶液一定是
不饱和溶液
Ⅲ.上述方法可以将两者完全分离
Ⅳ.析出的晶体中只含有
⑤在一定温度下,将含69g
、18g
的混合物完全溶解在50g水中。改变温度使
析出,
不析出,则温度
(℃)的范围是(硝酸钾和氯化钠溶解度互不影响)。
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。某硫酸品粗品中含有少量CaCl 和Mg Cl
和Mg Cl ,实验室进行提纯的流程如下:
,实验室进行提纯的流程如下:
回答下列问题:用NaOH和Na
 CO
CO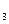 除杂时,反应的化学方程式分别为
除杂时,反应的化学方程式分别为NaOH和Na
 CO
CO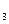 如果添加过量了,可加入适量 溶液除去。
如果添加过量了,可加入适量 溶液除去。“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至 (填序号)。
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液已知硫酸钠的溶解度随温度变化的曲线如下图所示。40℃时,100g蒸馏水中溶解 g硫酸钠达到饱和。将该饱和溶液升高温度到90℃,观察到的现象是
