下图是甲、乙两种固体的溶解度曲线,下列叙述正确的是
| A.20℃时,甲的溶解度大于乙的溶解度 |
| B.40℃时,甲、乙溶液中溶质的质量分数相等 |
| C.采用降温的方法可将乙的不饱和溶液转化为饱和溶液 |
| D.60℃时,甲的饱和溶液中溶质与溶液的质量比为3:8 |
下列有关溶液的说法中,正确的是
| A.溶液都是澄清、透明、无色的 |
| B.溶液都是由一种溶质和一种溶剂混合而成的 |
| C.饱和溶液中溶质的质量分数一定比不饱和溶液中溶质的质量分数大 |
| D.降低饱和溶液的温度析出晶体后,溶液中溶质的质量分数一定减小 |
海水淡化可采用膜分离技术.如图一所示,对淡化膜右侧的海水加压,在其左侧得到淡水.其原理是海水中的水分子可以透过淡化膜,而其他各种离子不能透过。
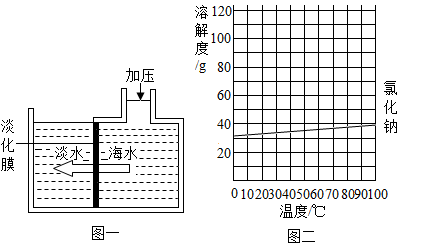
请回答:
(1)采用膜分离技术淡化海水的原理,与化学实验中常见的操作相似。
(2)对淡化膜右侧的海水加压后,海水中溶质的质量分数会(填"增大"、"减小"或"不变")。
(3)海水中含有大量的氯化钠,图二是氯化钠的溶解度曲线,据此可知盐场从海水中得到食盐晶体利用的方法是结晶(填"降温"或"蒸发")。
下图是甲、乙、丙三种物质的溶解度曲线。下列说法错误的是
| A.要配制相同质量分数的甲、丙两种物质的饱和溶液,应该将温度控制在t1 ℃ |
| B.t2 ℃时,将30 g甲物质加入到50 g水中不断搅拌,形成的溶液的质量是80g |
| C.要从甲物质的饱和溶液中获得晶体甲,可采用降温结晶的方法 |
| D.将丙物质的饱和溶液转化为不饱和溶液可以采用加水或降温的方法 |
小明喜欢养金鱼,他上网查阅资料得知:鱼缸中每升水的溶氧量低于0.003g时,鱼就会死亡。过氧化钙(
)是一种化学增氧剂,其反应原理是
请回答:
(1)氧气在水中的溶解度随温度的升高而。
(2)小明将2.88g过氧化钙放入盛有200L水的鱼缸中,请你通过计算分析,当氧气完全释放后,鱼缸中水的溶氧量是否符合最低要求?(假设产生的氧气完全溶入水,其他因素忽略不计)
下图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是
| A.乙的饱和溶液由t2℃降温到t1℃时,溶质的质量分数不变 |
| B.甲中含有少量乙,可以用冷却热饱和溶液的方法提纯甲 |
| C.t1℃时,50g水中分别加入25g的甲、乙,均可得到75g的饱和溶液 |
| D.t1℃时,等质量甲、乙两物质的饱和溶液蒸发等质量的水,所得溶液中溶质的质量一定相等 |
下图甲是A、B、C三种固体物质的溶解度曲线图。

(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是 P点所表示的含义为_____ __ 。
(2)t2℃时,将B物质的不饱和溶液转变成饱和溶液可采取的方法__________________。
(3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪一种? 。
下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/g |
Ca(OH)2 |
0.19 |
0.17 |
0.14 |
0.12 |
0.09 |
0.08 |
| NaOH |
31 |
91 |
111 |
129 |
313 |
336 |
|
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是 (填A或B)。

(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。
其中措施正确的是 。
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(3)20℃时,191g饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为 。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数乙 甲(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是 。
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH (填“偏大”、“偏小”或“不受影响”)。
、
、
三种物质的溶解度曲线如图5所示。下列分析正确的是

| A. |
℃时, 、 两种物质的饱和溶液中溶质的质量相等 |
B. |
℃时,把50 放入50 水中能得到 的饱和溶液,其中溶质和溶液的质量比为 |
| C. |
将 ℃时, 、 、 三种物质的饱和溶液降温至 ℃,所得溶液的溶质质量分数的大小关系是 |
D. | 将 的饱和溶液变为不饱和溶液,可采用升温的方法 |
如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是( )

| A. |
t 1℃时a、c两物质溶液中溶质的质量分数相等 |
| B. |
t 2℃时,物质a的100g饱和溶液中含有25g物质a |
| C. |
t 2℃时,分别将a、b、c的饱和溶液降温至t 1℃,溶质质量分数关系是b>a=c |
| D. |
t 2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量一定小于65g |
将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为4.0%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
| 反应时间(s) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 溶液温度(℃) |
20.5 |
20.6 |
20.7 |
20.8 |
20.9 |
20.8 |
20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是 ℃
(2)计算稀盐酸中溶质的质量分数(精确到0.1%)

如图表示M、N两种物质的饱和溶液的溶质质量分数随温度变化的曲线。现分别向50克M、80克N固体中各加入150克水,并加热至完全溶解,同时各蒸发掉50克水,冷却至t℃,下列分析正确的是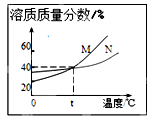
| A.M、N两溶液的溶质质量分数相等 |
| B.只有N析出晶体 |
| C.M、N均有晶体析出 |
| D.M、N两溶液都是饱和溶液。 |
如图是
、
、
三种固体物质的溶解度曲线,下列分析不正确的是
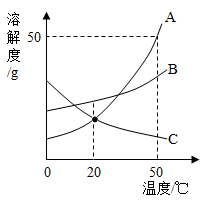
| A. |
50℃时,三种物质的溶解度由大到小的顺序是 |
| B. |
50℃时,把50 放入50 水中形成75 的饱和溶液 |
| C. |
20℃时, 和 两种物质的溶解度相等 |
| D. |
分别将三种物质的饱和溶液从50℃降至20℃时,所得溶液溶质质量分数大小关系是 |
下列关于溶液的叙述正确的是
| A.汽油洗衣服上的油污是利用了乳化作用 |
| B.硝酸铵固体溶于水时仅发生扩散吸热的过程 |
| C.某物质的不饱和溶液变为饱和溶液后溶质质量分数可能不变 |
| D.“波尔多液”是无色、透明、均一稳定的混合物 |
如图是a、b、c三种固体物质的溶解度曲线

(1)在t1℃时,a、b、c三种物质中,溶解度最大的是 ;
(2)t1℃时,将30g a物质放入100g水中,充分搅拌,所形成的溶液是 溶液(填“饱和”或“不饱和”);溶液中溶质的质量分数是 (精确到0.1%);此时若将温度由t1℃升至t2℃,还应再加入a物质 g,才能变成饱和溶液。
(3)从a、c的饱和溶液中提取a,应采用方法是 (填“冷却结晶”或“蒸发溶剂”)。