请根据以下实验,回答问题。
| 步骤 |
实验操作 |
实验结果 |
| 1 |
取50克水,加入10gKNO3,搅拌,恢复到20℃ |
全部溶解,得溶液a |
| 2 |
再加5.8g KNO3,搅拌,恢复到20℃ |
恰好饱和,得溶液b |
| 3 |
再加10gKNO3,搅拌,恢复到20℃ |
得溶液c |
| 4 |
加热 |
全部溶解,得溶液d |
| 5 |
冷却到20℃ |
析出晶体,得溶液e |
①上述所得溶液c的质量为 (15) g;
②20℃时,KNO3的溶解度为 (16) g/100g水;
③上述溶液a~e中,无法判断是否饱和的是 (17) (填溶液序号,下同),溶质质量分数一定相等的是(18) ;
④步骤5中,析出晶体的质量为 (19) g。
(1)下图是不与水发生化学反应的a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
①P 点的含义是 。
②t 2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是 (填写物质序号)。
③t 2℃时30ga物质加入到50g水中不断搅拌,所得溶液的溶质质量分数 。
④将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是 (填写选项序号)。
| A.c>a=b | B.a=b>c | C.a>b>c | D.b>a>c |
(2)根据下表回答:
| |
OH- |
NO3- |
Cl- |
SO42- |
CO32- |
| H+ |
|
溶、挥 |
溶、挥 |
溶 |
溶、挥 |
| Na+ |
溶 |
溶 |
溶 |
溶 |
溶 |
| Ca2+ |
微溶 |
溶 |
溶 |
微溶 |
不溶 |
| Cu2+ |
不溶 |
溶 |
溶 |
溶 |
不溶 |
| Ba2+ |
溶 |
溶 |
溶 |
不溶 |
不溶 |
| Zn2+ |
不溶 |
溶 |
溶 |
溶 |
不溶 |
①BaCO3的溶解性 。从上表中找出一种不溶碱 (填化学式)。
②Zn(NO3)2、BaCl2两种溶液能不能发生反应? (填:能”或“不能”)
③利用上表写一个有氢氧化铜生成的复分解反应化学方程式: 。
下图是a、b、c三种物质的溶解度曲线,下列说法错误的是
| A.t2℃时,a、c两种物质的溶解度相同 |
| B.升高温度可使接近饱和的c溶液变为饱和溶液 |
| C.t1℃时,a、b、c三种物质的溶解度由大到小的顺序是c>b>a |
| D.将t2℃时a、b、c的饱和溶液同时降温至t1℃后,析出晶体最多的物质是a |
右图是甲、乙、丙三种固体物质的溶解度曲线。
下列说法不正确的是
| A.在t2℃时,甲、乙两种物质的溶解度相等 |
| B.0℃时,将20g甲物质加入50g水中,所得溶液质量为70g |
| C.t1℃时,将丙的饱和溶液升温至t2℃,有晶体析出 |
| D.在tl℃时,甲的饱和溶溶和丙的饱和溶液中溶质的质量分数相同 |
下表是KNO3、NaCl在不同温度下的部分溶解度数据,请回答问题:
| 温度(℃) |
10 |
20 |
40 |
60 |
80 |
| KNO3 |
20.9 |
31.6 |
63.9 |
110 |
169 |
| NaCl |
35.8 |
36 |
36.6 |
37.3 |
38.4 |
(1)40℃时,将70gKNO3固体加入100g水中,充分搅拌,形成的溶液质量为 g。
(2)60℃时,KNO3的饱和溶液中含有少量NaCl,可通过 方法获得较纯净的KNO3晶体。
(3)t℃时,NaCl和KNO3的饱和溶液溶质质量分数相同,该温度范围是 。
A.10℃~20℃ B.20℃~40℃ C.40℃~60℃ D.60℃~80℃
(4)向20mL水中溶解一定量KNO3固体的操作如下图:请根据实验现象和溶解度数据回答:A、B、C中溶液一定不饱和溶液的是 。当x = g时,B中恰好没有固体剩余。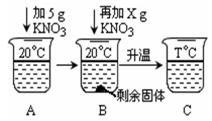
(8分)溶液在生产和科研中具有广泛的用途,与人们的生活密不可分。
(1)厨房中的下列物质加入水中,能形成溶液的有 (填编号);
a.面粉 b.食盐 c.白糖 d.牛奶
(2)下图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线。
①t2℃时,甲的溶解度 (填“>”、“<”或“=”)乙的溶解度;
②t1℃时,将50克的甲加入到100克的水中,充分搅拌后所得溶液的质量为 克;
③将t1℃时甲的饱和溶液升高温度到t2℃(假设水分没有蒸发),则与原溶液相比,所得溶液中溶质的质量分数将 (填“变大”、“变小”或“不变”);
④将t2℃时,甲、乙两种物质相同质量的饱和溶液,分别冷却到t1℃,析出晶体最多的是 物质。
(3)气体的溶解度也有一定的变化规律。
①打开可乐瓶,逸出大量气泡。由此可见,压强越小,CO2的溶解度越 。为增大CO2的溶解度,可采用的一种方法是 。
②不同温度下,氧气的溶解度随压强的变化如图所示,
图中t1对应的温度为40℃,则t2对应的温度 (填编号)。
a.大于40℃ b.小于40℃ c.无法确定
如图是
,
,
三种固体物质的溶解度曲线,请回答下列问题:

(1)
点的含义是;
(2)若
点混有少量
时,可采用的方法提纯
;
(3)
℃时,能不能配制溶质的质量分数为40%的
溶液?(填"能"或"不能");
(4)
℃时,将
,
,
三种固体物质各30
加入到100
水中,充分溶解,形成不饱和溶液的是;
(5)将
℃时
,
,
三种固体物质的饱和溶液升温到
℃,其溶质的质量分数由大到小的顺序是。
如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是( )

| A. |
t 1℃时a、c两物质溶液中溶质的质量分数相等 |
| B. |
t 2℃时,物质a的100g饱和溶液中含有25g物质a |
| C. |
t 2℃时,分别将a、b、c的饱和溶液降温至t 1℃,溶质质量分数关系是b>a=c |
| D. |
t 2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量一定小于65g |
将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为4.0%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
| 反应时间(s) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 溶液温度(℃) |
20.5 |
20.6 |
20.7 |
20.8 |
20.9 |
20.8 |
20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是 ℃
(2)计算稀盐酸中溶质的质量分数(精确到0.1%)

如图表示M、N两种物质的饱和溶液的溶质质量分数随温度变化的曲线。现分别向50克M、80克N固体中各加入150克水,并加热至完全溶解,同时各蒸发掉50克水,冷却至t℃,下列分析正确的是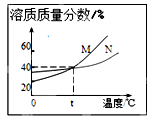
| A.M、N两溶液的溶质质量分数相等 |
| B.只有N析出晶体 |
| C.M、N均有晶体析出 |
| D.M、N两溶液都是饱和溶液。 |
如图是
、
、
三种固体物质的溶解度曲线,下列分析不正确的是
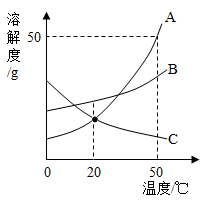
| A. |
50℃时,三种物质的溶解度由大到小的顺序是 |
| B. |
50℃时,把50 放入50 水中形成75 的饱和溶液 |
| C. |
20℃时, 和 两种物质的溶解度相等 |
| D. |
分别将三种物质的饱和溶液从50℃降至20℃时,所得溶液溶质质量分数大小关系是 |
下列关于溶液的叙述正确的是
| A.汽油洗衣服上的油污是利用了乳化作用 |
| B.硝酸铵固体溶于水时仅发生扩散吸热的过程 |
| C.某物质的不饱和溶液变为饱和溶液后溶质质量分数可能不变 |
| D.“波尔多液”是无色、透明、均一稳定的混合物 |
如图是a、b、c三种固体物质的溶解度曲线

(1)在t1℃时,a、b、c三种物质中,溶解度最大的是 ;
(2)t1℃时,将30g a物质放入100g水中,充分搅拌,所形成的溶液是 溶液(填“饱和”或“不饱和”);溶液中溶质的质量分数是 (精确到0.1%);此时若将温度由t1℃升至t2℃,还应再加入a物质 g,才能变成饱和溶液。
(3)从a、c的饱和溶液中提取a,应采用方法是 (填“冷却结晶”或“蒸发溶剂”)。
除杂(括号内为杂质)方法错误的是
| A.N2(O2)通过灼热的铜网 | B.KNO3(NaCl)溶解、蒸发浓缩后降温结晶 |
| C.CaO(CaCO3)加水后过滤 | D.CO2 (CO) 通过灼热的氧化铜 |