氯化钠是生产、生活中的一种重要化合物,应用很广泛。
Ⅰ.图甲和图乙分别是钠原子和氯原子的原子结构示意图。

(1)图甲中的x= 。
(2)金属钠与氯气反应时,由图乙的结构可知,氯原子容易得到钠失去的1个电子,从而形成最外层有 个电子的相对稳定的氯离子,氯离子用化学符号表示为 。
Ⅱ.如表是氯化钠在不同温度下的溶解度数据。
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
(1)30℃时,将10g氯化钠加入到50g水中,充分搅拌后,所得到的氯化钠溶液属于
(填“饱和”或“不饱和”)溶液。
(2)医用盐水(溶质为NaCl)的溶质质量分数为0.9%,现有200mL该盐水(假定该溶液的密度为1g/mL),其中含NaCl的质量为 g。
(3)学生化学实验活动之一:配制50g质量分数为6%的氯化钠溶液,该实验需要的仪器有药匙、托盘天平、玻璃棒、胶头滴管、 (从下列图中选择写出名称)。

Ⅲ.工业上常用电解饱和食盐水的方法来制取氢氧化钠、氯气和氢气,其化学反应方程式可表示为:xNaCl+yH2O zNaOH+wH2+vCl2↑,若w=v=1,那么x=y=z=
zNaOH+wH2+vCl2↑,若w=v=1,那么x=y=z=
(填数字)。
硝酸钾的溶解度曲线如图所示。回答下列问题:
(1)30℃时,硝酸钾的溶解度是 g。
(2)60℃时,在100g水中加入60g硝酸钾固体,充分搅拌,所得溶液是 (填"饱和"或"不饱和")溶液。
(3)将(2)中所得的溶液从60℃降温至30℃,可析出硝酸钾晶体 g,此时溶液的溶质质量分数 45.8%(填">""<"或"=")。

水是生命之源,也是实验室常用的溶剂。
(1)生活中既能降低水的硬度,又能杀菌消毒的方法是 。
(2)含氮物质进入水中会使水质恶化,这里的"氮"是指 (填序号)。
A.原子
B.分子
C.元素
(3)在某温度下,分别向盛有等质量蒸馏水的两烧杯中逐渐加入固体溶质甲和乙,图中x表示所加固体的质量,y表示溶液中溶质与水的质量比。a点对应的乙物质的溶液为 (选填"饱和"或"不饱和")溶液;该温度时甲物质的溶解度为 g。

(1)水与人类的生活密切相关。
①硬水给生活和生产带来许多麻烦,一般可用 来区分硬水和软水。
②可利用活性炭吸附水中的异味和色素,活性炭的吸附性属于 (填“物理”或“化学”)性质。
(2)下表是KNO3和Ca(OH)2在不同温度时的溶解度。回答有关问题:
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度/g |
KNO3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110.0 |
Ca(OH)2 |
0.19 |
0.17 |
0.16 |
0.14 |
0.13 |
0.11 |
|
①两种物质中,溶解度随温度升高而减小的是 。
②60℃时,按图示操作:
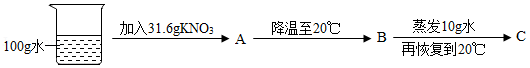
A中的溶液是 (填“饱和”或“不饱和”)溶液。
C中析出固体的质量是 g。
③如图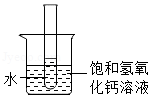 ,向烧杯中加入一定量的硝酸铵固体,此时试管中氢氧化钙溶液的溶质质量分数将 (填“变大”不变”或“变小”)。
,向烧杯中加入一定量的硝酸铵固体,此时试管中氢氧化钙溶液的溶质质量分数将 (填“变大”不变”或“变小”)。
为M、N两种固体物质的溶解度曲线,据图回答:
(1)b点表示的意义是 。
(2)t2℃时,将M溶液的状态由a点转化到b点,可采用的方法是 和 。
(3)将t1℃时,M和N的饱和溶液各100g降温至t0℃,过滤,得到滤液m和滤液n。关于m和n的说法正确的是 (填序号)。
A.都是饱和溶液 B.溶液质量:m<n C.溶剂质量:m<n
D.溶质质量:m=n E.溶质的质量分数:m=n
