如图是实验室配制一定溶质质量分数的NaCl溶液的流程图。

请回答:
(1)应称量 gNaCl,需加水 mL。
(2)若称量NaCl固体时指针向右偏转,则应 直到天平平衡。
(3)取上述溶液10g加水稀释到 g,可得到5%的NaCl溶液。
实验室配制氯化钠溶液的操作中,错误的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
某同学模拟闽籍化学家侯德榜的"侯氏制碱法"制纯碱,需用50.0g水配制20℃的NaCl饱和溶液(20℃时NaCl的溶解度为36.0g),应称取NaCl的质量为( )
| A. |
18.0g |
B. |
16.0g |
C. |
13.2g |
D. |
11.5g |
农业废弃物是指农业生产过程中废弃的有机物,如秸秆、蔗渣等.
(1)农业废弃物经发酵处理可获得沼气(主要成分为甲烷).甲烷完全燃烧的化学方程式为 .
(2)闽籍科学家张俐娜发明了一种快速溶解农业废弃物的“神奇溶剂”.该“神奇溶剂”中氢氧化钠、尿素和水的质量比为7:12:81.
①“神奇溶剂”是一种溶液,其溶质有 .
②某次生产需用到100kg“神奇溶剂”.现仅用氢氧化钠溶液和尿素来配制,所用的氢氧化钠溶液的溶质质量分数为 (列出计算式即可).
③利用该“神奇溶剂”溶解农业废弃物生产的新型纤维素膜,在土壤中能完全降解.利用此膜替代普通塑料,可缓解的环境问题是 (写一点)
欲配制10.0%的NaCl溶液50g,部分操作如下图所示,正确的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
以下实验室配制一定溶质质量分数的氯化钠溶液的流程示意图.
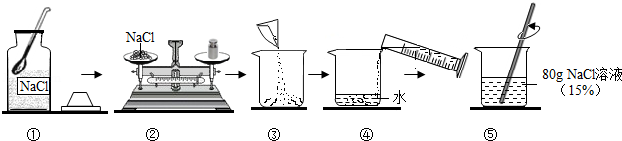
请根据示意图回答.
(1)托盘天平左盘中固体氯化钠的质量为 g,量筒中水的体积为 mL;
(2)上述溶液取10g加水40g进行稀释,所得氯化钠溶液的溶质质量分数是 .
如图是硫在氧气中燃烧的实验改装装置:
(1)写出分解过氧化氢制取氧气的化学方程式: 。
(2)硫在氧气中燃烧的现象是: 。
(3)本实验中电烙铁的作用是: 。
(4)配制50g溶质质量分数为5%的氢氧化钠溶液,需要氢氧化钠的质量 。
(5)本实验具有的优点是: 。(写一点即可)

化学与生产、生活息息相关。
(1)水稻生长初期需要施氮肥,下列属于氮肥的是 。
A.K 2CO 3 B.(NH 4) 2SO 4 C.Ca 3(PO 4) 2 D.CO(NH 2) 2
(2)农业上常用溶质质量分数为16%的氯化钠溶液选种,现要配制100Kg这种溶液,需要 Kg氯化钠,配制该溶液的主要步骤有:①计算 ②称量 ③量取 ④ 。
(3)自行车是"绿色出行"的交通工具,为防止其链条生锈常采用的方法是 ;自行车支架使用的铝合金是 材料(填"金属"或"合成"),铝离子结构示意图如图 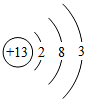 ,铝在化学反应中易 (填"得"或"失")电子,她的离子符号为 。
,铝在化学反应中易 (填"得"或"失")电子,她的离子符号为 。
泡菜是常见的腌制食品,因含亚硝酸盐(如NaNO2)而引发人们的关注。根据要求回答问题:
Ⅰ.腌制泡菜时,蔬菜中的NaNO3转化为NaNO2.食用泡菜时,NaNO2与胃酸反应生成HNO2.HNO2不稳定,转化为某氮氧化物(常温下为红棕色气体)进入血液而中毒。
(1)NaNO2与胃酸(主要成分为盐酸)发生复分解反应,该反应的化学方程式为 。
(2)图1为泡菜生产和食用时涉及的四种含氮物质的类别及氮元素化合价关系图。其中,L的化学式为 。
(3)为检验某无色溶液是NaNO2还是NaCl,完成实验方案。
选取的试剂 |
实验现象 |
实验结论 |
|
|
该溶液为NaNO2溶液 |
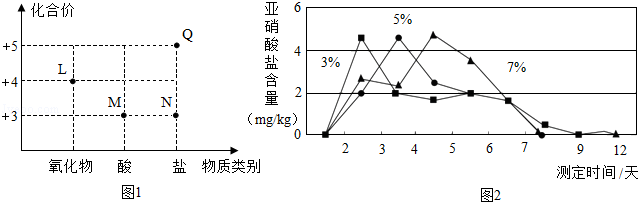
Ⅱ.室温下,用3%、5%和7%的食盐水浸泡蔬菜,浸泡不同时间获得的泡菜中亚硝酸盐的含量如图2所示。若往食盐水中添加少量维生素C,泡菜中亚硝酸盐含量明显降低。
(4)配制3%的NaCl溶液2000.0g,需用托盘天平称取 g的NaCl。
(5)食盐水的溶质质量分数越大,泡菜中亚硝酸盐含量最大值出现得 (填“越早”、“越迟”或“无影响”)。
Ⅲ.实际上,只要合理制作、食用泡菜,将有效避免(或降低)对人体的危害。
(6)列举一条避免(或降低)食用泡菜对人体危害的措施。
答: 。
用所给实验器材(规格和数量不限),就能顺利完成相应实验的是( )
| 选项 |
相应实验 |
实验器材(省略夹持装置) |
| A |
硫酸铜晶体的制备和生长 |
烧杯、玻璃棒、蒸发皿、量筒 |
| B |
分离氯化钾和二氧化锰的混合物 |
烧杯、玻璃棒、胶头滴管、滤纸 |
| C |
用固体氯化钠配制5%的溶液 |
烧杯、玻璃棒、胶头滴管、量筒 |
| D |
用pH试纸测定溶液的酸碱性强弱 |
烧杯、玻璃棒、pH试纸、标准比色卡 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
某同学梳理归纳了以下知识:①硬水通过活性炭吸附后可变为软水②二瓶气体元素组成相同、各元素的质量分数相同,则它们的化学性质一定相同③离子是带电的粒子,所以带电的粒子一定是离子④配制6%的氯化钠溶液,量取水时,俯视量筒刻度会使所配氯化钠溶液质量分数偏高⑤所谓“低碳”就是较低二氧化碳的排放⑥除去铜粉中混有的少量炭粉,可采用在空气中灼烧混合物的方法,其中正确的个数有( )
A.1个B.2个C.3个D.4个
实验室常会产生含硫酸的废水,需经处理至中性。某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水。
(l)定性检测废水
检测废水呈酸性的方法是 。
(2)配制200g质量分数为5.6%的氢氧化钾溶液
①计算
m (KOH)= g,V(H 2O)= mL(水的密度近似为1.0g•mL ﹣ 1)。
②称取氢氧化钾
调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量。然后 (按操作先后顺序,填字母),直至天平平衡。
A.向烧杯中加氢氧化钾固体 B.按需要添加砝码、移动游码 C.量取水 D.溶解 E.转移。
(3)定量测定废水
取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示。(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)
①P点对应溶液中一定存在的阳离子有 (填离子符号)。
②酸性废水中硫酸的质量分数为 (用百分数表示,保留到0.1%)。
③计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示,保留到0.l%)。

"一定溶质质量分数的NaOH溶液的配制"实验操作示意图如下,其中正确的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1)可以作为溶质的是 。
A.只有固体 B.只有液体 C.只有气体 D.气体、液体、固体都可以
(2)配制100g质量分数为16%的氯化钠溶液,所需氯化钠的质量为 ,水的体积为 mL (水的密度近似看作1g/cm 3)。
(3)甲、乙两种不含结晶水的固体物质的溶解度曲线如图1.t 1℃时,甲物质的溶解度是 。t 2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是 (填"甲"或"乙")物质的饱和溶液。

(4)按图2所示装置,将液体X注入装有固体y的试管中,会导致U形管中右端液面升高。则可能的组合是 。
| 选项 |
x |
y |
| A |
水 |
氧化钙 |
| B |
水 |
硝酸铵 |
| C |
浓硫酸 |
水 |
| D |
稀盐酸 |
镁 |