实验技能是学习化学和进行探究活动的基础和保证。
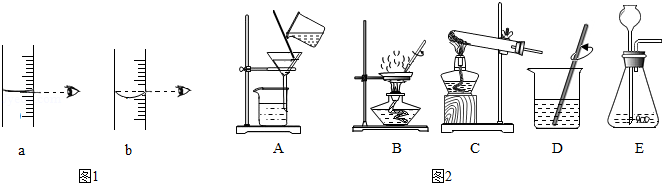
(1)实验室配制50g质量分数为6%的NaCl溶液,用到的玻璃仪器除试剂瓶、量筒、胶头滴管外,还需要 。量取读数时,如图视线角度正确的是 (填序号)。
(2)请根据如图装置或操作回答相关问题。
①选取图2中的序号,表示粗盐提纯的正确操作顺序为 。操作B的名称是 ,该操作中当 时,应停止加热。
②实验室用高锰酸钾固体制取氧气时,可选用的发生装置是 (填序号)。
溶液在日常生活、工农业生产和科学研究中具有广泛用途。
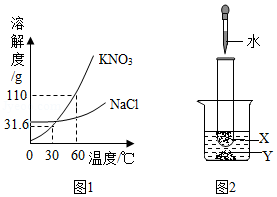
(1)KNO3属于复合肥,所含的营养元素有 ,溶质质量分数为3%的KNO3溶液常用作无土栽培的营养液,配制100g该营养液需要的溶质是 ,其质量为 g,配制时常用玻璃棒搅拌,目的是 。
(2)某KNO3固体(混有少量NaCl),要用它配制上述营养液,需在配制前进行提纯(图1为溶解度曲线),60℃时,KNO3的溶解度为 g,将该固体溶于水配制为接近饱和的溶液,可采用降温结晶的方法提纯KNO3,其理由是 。
(3)探究温度对溶解度的影响,如图2所示。固体X是NH4NO3或NaOH,固体Y是KNO3或Ca(OH)2,烧杯中盛放20℃Y的饱和溶液(有少量Y的固体剩余),往试管中滴入适量水,烧杯中固体逐渐消失,写出X与Y可能的组合 。
实验室配制饱和澄清石灰水和质量分数为10%的氢氧化钠溶液,并进行有关实验。
下表是20℃时部分物质的溶解度数据。
物质 |
Ca(OH)2 |
NaOH |
CaCO3 |
Ca(HCO3)2 |
Na2CO3 |
NaHCO3 |
溶解度/g |
0.16 |
109 |
0.0065 |
16.6 |
21.8 |
9.6 |
(1)配制溶液。其中配制100g 10%氢氧化钠溶液的基本步骤是:
称取氢氧化钠固体﹣量取水﹣溶解﹣装瓶﹣贴标签。
①称取氢氧化钠固体的质量 g。
②已知水的密度为1g/cm3,用100mL量筒量取所需的水,画出水的液面。
③装瓶后贴标签,在标签上填写: 。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是 。
②向10%氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是 。
③理论上吸收4.4gCO2,需饱和澄清石灰水的质量至少为 g,或需10%氢氧化钠溶液的质量至少为 g.(计算结果精确到个位)

配制100g质量分数为16%的Na2CO3溶液,用于演示灭火器原理。回答下列问题。
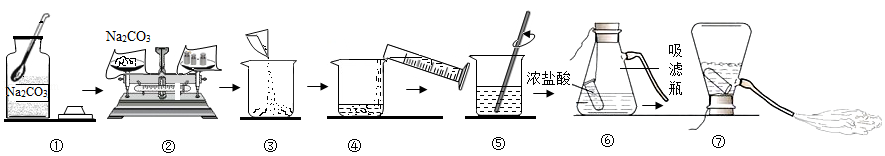
(1)计算Na2CO3的质量为 g,称量Na2CO3的仪器名称是 。
(2)20℃时,Na2CO3的溶解度为21.5g,⑤中的溶液 (填“是”或“不是”)该物质的饱和溶液。
(3)将烧杯中溶液倒入吸滤瓶的操作是 ,从橡胶管喷出大量液体的原因是 。
(4)酒精(C2H5OH)可作燃料,在空气中完全燃烧的化学方程式是 。酒精燃烧失火,可用干粉灭火器灭火。NaHCO3是干粉的主要成分,俗称是 。用干粉灭火器灭火的正确操作顺序是 → → (填序号)。
学习了酸、碱、盐有关知识后,小明在实验室称量氢氧化钠固体,配制了溶质质量分数为10%的氢氧化钠溶液,进行以下探究:

(1)若图Ⅰ中游码标尺读数为1.8,则他称取的氢氧化钠质量是 g.
(2)图Ⅱ中反应的化学方程式是 .
(3)图Ⅲ中玻璃棒的作用是 ,当出现较多固体时,应 .
某同学配制50g 6%的氯化钠溶液,整个操作过程中如图所示,回答下列问题:
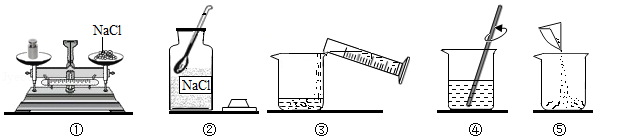
(1)配制溶液的正确操作顺序为 (填序号,下同),其中操作错误的是 。
(2)图②中盛放氯化钠固体的仪器名称是 ,需称取氯化钠 g。
(3)量水时选用的量筒的量程最合适的是 (填序号),读数时视线要与量筒内 保持水平。
A.10mLB.25mLC.50mLD.100mL
(4)取上述溶液10g加水 g,可稀释得到3%的NaCl溶液。
(5)若该同学配制的溶液溶质质量分数偏小,可能的原因是 (填序号)。
A.氯化钠固体不纯B.用生锈砝码称量
C.装瓶时有少量溶液洒出D.溶解前烧杯内有少量水
如图是初中化学中的一些常用实验仪器或装置:

(1)实验室用高锰酸钾制取氧气的化学方程式是 ,常用来收集氧气的装置是 (填字母序号).
(2)小李要配制50g质量分数为10%的NaCl溶液,并装入试剂瓶备用.
①要完成该实验,如图中还缺少的仪器是 (填名称).
②该实验过程中,玻璃棒的作用是 .
(3)用试纸测定溶液pH值的方法是:将小片pH试纸放在洁净的玻璃片上, ,与标准比色片比较,读出pH,若pH试纸事先用水湿润,测出的食醋pH值 (填“偏大”、“偏小”或“没有影响”).
某化学课外兴趣小组欲配制80g质量分数为12%的氢氧化钠溶液来制作“叶脉书签”。
(1)需要氢氧化钠固体的质量为 g。
(2)称量时,氢氧化钠固体应放在 (填“滤纸”或“烧杯”)中。
(3)下列说法或操作正确的是 (填字母序号)。
A、配制该溶液时所需的玻璃仪器中不包括玻璃棒
B、用量程为100mL的量筒量取所需要的水
C、将称量好的固体倒入装有水的量筒中溶解
(4)在量取水的体积时,若采用仰视的方法读数,则所配制的氢氧化钠溶液中溶质的质量分数将 (填“偏大”或“偏小”)。
(5)某同学用蒸馏水润湿了的pH试纸来测定配制好的溶液的pH值时,他测得的结果会 (填“偏大”、偏小”或“不变”)。
(6)该兴趣小组的同学提出还可以用配制好的氢氧化钠溶液和稀盐酸进行中和反应实验,具体操作如图:

在烧杯中加入10mL的氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液呈 色。接着加入一定量的稀盐酸,用玻璃棒搅拌后发现溶液为无色,此时 (填“能”或“不能”)得出两者恰好中和的结论。以下操作及实验现象能证明加入的盐酸为过量的是 (填字母序号)。
A、加入少量铁粉,无明显现象
B、滴加紫色石蕊溶液,搅拌后溶液变蓝
C、加入碳酸钠溶液,产生气泡
以下实验室配制一定溶质质量分数的氯化钠溶液的流程示意图.
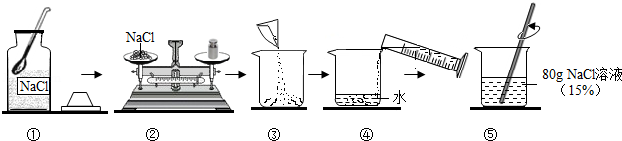
请根据示意图回答.
(1)托盘天平左盘中固体氯化钠的质量为 g,量筒中水的体积为 mL;
(2)上述溶液取10g加水40g进行稀释,所得氯化钠溶液的溶质质量分数是 .
卓玛同学要用85g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”,如图是她配制氢氧化钠溶液的实验操作示意图。
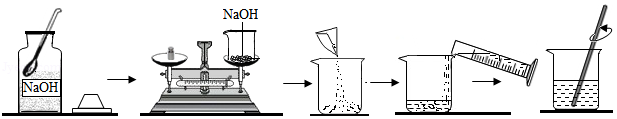
(1)卓玛同学配制该溶液时,需要称量 g氢氧化钠固体,应选择 mL(填“10”、“50”或“100”)的量筒来量取所需水的体积(水的密度可近似看作1g/cm3);
(2) 图中有一处操作有明显错误,该错误会导致所配制的氢氧化钠溶液的溶质质量分数 (填“偏大”“偏小”或“不变”)。
实验室按如图步骤配制100g质量分数为22%的蔗糖溶液。
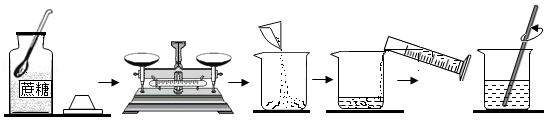 回答下列问题:
回答下列问题:
(1)所需蔗糖的质量为 。
(2)用规格为 (填“50”、“100”或“500”)mL的量筒量取 mL蒸馏水倒入盛有蔗糖的烧杯中进行溶解。(水的密度约为1g/cm3)
(3)溶解时玻璃棒的作用是 。
(4)下列情况会导致所配溶液中溶质的质量分数偏高的是 (填字母序号)。
A.蔗糖中混有少量杂质
B.称量时蔗糖和砝码位置放反了(使用了游码)
C.用于溶解蔗糖的烧杯洗净后残留有少量的水
D.用量筒量取水时,俯视读数
正确的操作是实验成功的保证。
(1)如图甲所示,实验室稀释浓硫酸时,①处的试剂是 (填字母序号),用玻璃棒不断搅拌的作用是 (填字母序号)。
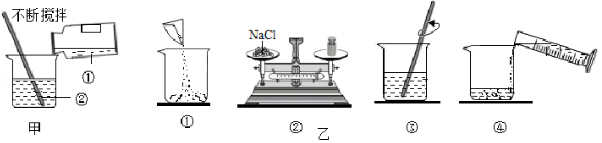
A.浓硫酸
B.水
C.引流
D.防止局部温度过高,造成酸液飞溅
(2)实验室配制一定溶质质量分数的氯化钠溶液的操作过程如图乙所示,正确的操作顺序是 (填字母序号)。
A.①②③④
B.②①④③
C.②①③④
配制一定溶质质量分数的氯化钠溶液的过程如图所示:

(1)写出图中标号a仪器的名称: 。
(2)配制50g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠 g,水 g。
(3)称量氯化钠时,氯化钠应放在托盘天平的 盘。(填"左"或"右")
(4)溶解过程中玻璃棒的作用是 。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有 。(填序号)
A.称量时,药品与砝码放反了B.量取水的体积时,仰视读数C.装瓶时,有少量溶液洒出
(6)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是 g。
正确选择实验仪器是实验成功的重要保证。下面是实验室中常见的仪器,请按要求填空。
(1)配制一定溶质质量分数的氯化钠溶液,需要用到的仪器有 (填序号),还缺少的两种仪器是 (填名称);过滤粗盐水所用到的仪器有 (填序号)。
(2)实验室用锌粒和稀硫酸制取氢气,可选用上述仪器中的 (填序号)组合成发生装置。
(3)利用仪器③与⑦可组合成一个贮气装置,收集氢气(氢气难溶于水、密度小于空气)时,气体应从仪器⑦的 (填“a”或“b”)端通入,该装置还有其他的用途,请你任举一例: 。