实验室有一瓶由氯化钾和硝酸钾组成的化肥,但标注的质量分数已模糊不清,小明想通过实验重新标注,以下是他进行的实验步骤:
①取10克样品于烧杯中,加入蒸馏水充分溶解,配制成60克溶液;
②在配制的溶液中,加入一定量的硝酸银溶液,恰好完全反应;
③将上述混合液过滤,沉淀经洗涤、干燥后,称得质量为14.35克。
3 3)
(1)在过滤操作中使用的玻璃仪器有:烧杯、 和玻璃棒。
(2)样品中氯化钾的质量分数为多少?(要求列式计算)
(3)完全反应后,混合液中的硝酸钾质量是多少克?
(4)为了回收硝酸钾,小明对滤液进行蒸发、结晶、称量,发现所得的晶体质量小于计算得出的理论值。造成这种结果的原因可能是 。(选填编号)
A.晶体没有干燥
B.蒸发时液体飞溅
C.硝酸钾残留在玻璃棒上
实验室常会产生含硫酸的废水,需经处理至中性。某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水。
(l)定性检测废水
检测废水呈酸性的方法是 。
(2)配制200g质量分数为5.6%的氢氧化钾溶液
①计算
m (KOH)= g,V(H 2O)= mL(水的密度近似为1.0g•mL ﹣ 1)。
②称取氢氧化钾
调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量。然后 (按操作先后顺序,填字母),直至天平平衡。
A.向烧杯中加氢氧化钾固体 B.按需要添加砝码、移动游码 C.量取水 D.溶解 E.转移。
(3)定量测定废水
取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示。(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)
①P点对应溶液中一定存在的阳离子有 (填离子符号)。
②酸性废水中硫酸的质量分数为 (用百分数表示,保留到0.1%)。
③计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示,保留到0.l%)。

溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1)可以作为溶质的是 。
A.只有固体 B.只有液体 C.只有气体 D.气体、液体、固体都可以
(2)配制100g质量分数为16%的氯化钠溶液,所需氯化钠的质量为 ,水的体积为 mL (水的密度近似看作1g/cm 3)。
(3)甲、乙两种不含结晶水的固体物质的溶解度曲线如图1.t 1℃时,甲物质的溶解度是 。t 2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是 (填"甲"或"乙")物质的饱和溶液。

(4)按图2所示装置,将液体X注入装有固体y的试管中,会导致U形管中右端液面升高。则可能的组合是 。
| 选项 |
x |
y |
| A |
水 |
氧化钙 |
| B |
水 |
硝酸铵 |
| C |
浓硫酸 |
水 |
| D |
稀盐酸 |
镁 |
海洋是巨大的资源宝库,从海洋中可以获得很多物质,连云港水资源丰富。
(1)通过晾晒海水得到的粗盐中含有多种可溶性杂质和不溶性杂质(泥沙等)。实验室中除去粗盐中不溶性杂质获得精盐的步骤是:溶解→过滤→蒸发→计算产率等。
①过滤操作中玻璃棒的末端要轻轻的斜靠在 一边。蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作是 。
②下列操作可能导致精盐产率偏高的是 (填字母)
a.食盐没有完全溶解即过滤 b.过滤时液面高于滤纸边缘
c.器皿上粘有的精盐没有全部转移到称量纸上
(2)海水中含量最多的氯化物是氯化钠,其次是氯化镁。如图1是从海水中获得氯化镁溶液的流程。
①在海水中加入石灰乳后,发生反应的化学方程式是 。
②上述过程中试剂A与沉淀B发生的是中和反应,则试剂A是(填名称) 。
(3)2017年5月18日,在中国南海海域实现可燃冰(CH 4•nH 2O)试采成功,这将使人类能源格局翻开新篇章。
①可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N 2、CO 2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于 (选填"纯净物"或"混合物")。
②若某种可燃冰中CH 4与H 2O的质量比是1:9,则该可燃冰中n= 。
③可燃冰中甲烷完全燃烧的化学方程式是 。
某兴趣小组进行纯碱样品(杂质仅含NaCl)中Na 2CO 3质量分数的测定实验,主要操作流程如图:

(1)请指出图中过滤操作中的一处错误: 。
(2)为节约药品,可先向呈碱性的Na 2CO 3溶液中滴加无色酚酞试液,溶液呈 色,再向溶液中滴加CaCl 2溶液至颜色恰好消失,即可停止滴加。
(3)以下操作过程会导致Na 2CO 3质量分数测定值偏小的有 。
A.称量沉淀质量时忘记读取游码所示的值(不为零)
B.沉淀未完全烘干就进行称量
C.溶解时,充分搅拌后,样品未能完全溶解即进行下步操作。
质疑与探究是科学课堂永恒的主题,下列是小科同学对气体收集方式本质原因的探究。
(1)有些同学说:"CO 2要用向上排空气法收集,不能用向下排空气法收集。"小科同学疑惑:为什么不能用向下排空气法收集?于是,进行了如下对比实验:
用图甲和图乙两种方式收集CO 2,通入的气体流速和时间相同,发现甲集气瓶收集到的CO 2浓度交大,乙集气瓶的CO 2浓度较小,请分析两者浓度相差较大的原因。
(2)有些同学说:"O 2可以用排水集气法收集,但CO 2不能用排水集气法收集。"对此,小科同学疑惑:于是,又进行了如下对比实验:用图丙装置分别以相同流速通入O 2和CO 2,发现收集满O 2比CO 2耗时少,请分析原因。

焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂,小金模仿化工生产,用如图装置来制取Na2S2O5。
已知:A中发生的反应为:H2SO4(浓)+Na2SO3═Na2SO4+SO2↑+H2O
B中发生的反应为:Na2SO3+SO2═Na2S2O5

(1)图中盛放浓硫酸的仪器名称是 ;
(2)写出C中发生反应的化学方程式 ;
(3)在实验过程中,滴加浓硫酸不宜过快,理由是 。
(4)该实验开始滴加浓硫酸时,应先除尽装置内的空气,若忘记这一操作,新制取的Na2S2O5产品中会混有Na2SO4杂质,这与O2的 有关(填化学性质)
绿矾(FeSO4•7H2O)是硫酸法生产太白粉的主要副产物,可用于制备Fe2O3,复印用Fe3O4粉、还原铁粉等,开发利用绿矾工艺是一项十分有意义的工作。某研究性小组展开了系列研究。
Ⅰ制备Fe2O3
【资料一】
(1)无水硫酸铜遇水变成蓝色的硫酸铜晶体。
(2)绿矾(FeSO4•7H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物。
(3)SO2是无色有窒息性臭味的有毒气体,能使品红溶液褪色。
甲同学用如下装置制备Fe2O3并验证绿矾受热分解的其他产物;

实验过程中发现:A中有 色固体生成,B中无水硫酸铜变蓝,C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,装置E的作用是 ,绿矾高温分解的化学方程式为 。
Ⅱ制备Fe3O4
乙同学模拟生产复印用Fe3O4粉的实验流程如下:

【资料二】Fe(OH)2是一种白色难溶于水的固体,在空气中易被氧化。
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为① ,②4Fe(OH)2+O2+2H2O═4Fe(OH)3.由沉淀a获得Fe3O4的化学方程式为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
若制取Fe(OH)2,采取的实验操作是:向盛有5mL新制FeSO4溶液的试管中加入10滴植物油,然后用胶头滴管加煮沸的NaOH溶液(驱赶O2),胶头滴管的正确使用方法是 (填字母)。

Ⅲ制备还原铁粉
制备还原铁粉的工业流程如下:

(1)操作1的名称是 ,NH4HCO3和FeSO4溶液反应的化学方程式为 。
(2)若将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量FexC)在氧气流中完全反应,得到0.22gCO2,将相同质量的粗还原铁粉与足量稀硫酸反应,得到0.48gH2(FexC与稀硫酸反应不产生H2)。试通过计算确定FexC的化学式(请写出计算过程) 。
(3)粗还原铁粉经加工处理后变成纯还原铁粉,纯还原铁粉和水蒸气在高温条件下也可制得四氧化三铁,同时生成一种气体。其装置如图所示:

SAP材料吸水性强,湿润的SAP材料能为该反应持续提供水蒸气。实验开始一段时间后,观察到在肥皂液中有大量的气泡产生,此气泡用火柴即能点燃,同时有肥皂泡飘到空中。生成的气体是 ,干燥的SAP材料作用是 。
根据如图装置图,回答有关问题。

(1)写出装置图中标号仪器的名称:a ,b 。
(2)写出实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式 ,可选用的发生装置是 (填字母)。
(3)写出实验室用高锰酸钾制取氧气的化学方程式 ,如图E装置来收集氢气,当导管口气泡 放出时,再把导管口伸入盛满水的集气瓶,开始收集。
认识常用仪器,学习一些实验的基本操作,才能正确、安全地进行实验,回答下列问题.
(1)用作配置溶液和较大量试剂的反应容器是 .
(2)把玻璃管插入橡胶塞的孔里,应先将玻璃管口 .
(3)细铁丝在氧气中燃烧,实验结束后发现集气瓶底部炸裂,原因是 .
请用所学的知识回答下列问题:
(1)量取液体时,如果视线没有与量筒内无色液体凹液面的最低处保持水平,而是采用俯视的方法,将会对读数产生什么影响?
(2)为什么菜刀、镰刀、锤子等用铁制而不是铝制?
氧化锌软膏可用于急性或亚急性皮炎、湿疹、痱子及轻度、小面积的皮肤溃疡。闪锌矿(主要成分为ZnS)是含锌的主要矿物质之一,高温煅烧闪锌矿生成氧化锌和SO2,以氧化锌产品为原料制备纯氧化锌的生产工艺流程如图:
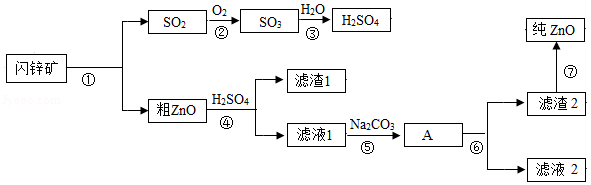
(1)已知A为碳酸锌和硫酸钠的混合物,则滤渣2的化学式为 。
(2)上述步骤中,步骤⑥的操作是 (填操作名称)。
(3)在上述步骤中,步骤 发生的反应属于分解反应。
(4)步骤④中发生的反应化学方程式为 (提示:ZnO与酸反应和Fe2O3与酸反应类似)。
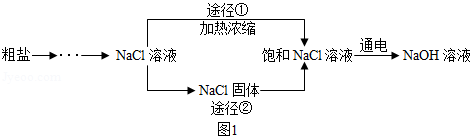
某同学设计的工业制备氢氧化钠的流程如图
1.
资料:2NaCl+2H2O 2NaOH+H2↑+C12↑,两电极,一端得到NaOH和H2,另一端得到Cl2。
2NaOH+H2↑+C12↑,两电极,一端得到NaOH和H2,另一端得到Cl2。
(1)晾晒海水得到粗盐的原理是
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、石棉网、酒精灯、玻璃棒和______
(3)工业生产中应选择途径 (“①”或“②”),理由是
(4)Cl2可用于生产84消毒液(有效成分 NaClO),反应原理为:Cl2+2NaOH=NaCl+NaClO+H2O,反应前后氯元素的化合价有 种。
(5)图2实验测定水组成,不能加入NaCl增强水的导电性的理由是 。电解水的化学方程式为 。
(6)图3实验获得84消毒液,直流电源正极应与 (填a或b)连接,才能使 NaClO的含量更高。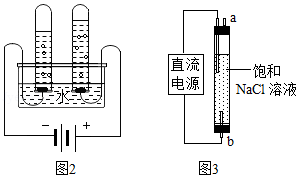
根据下列实验装置或操作示意图回答问题:
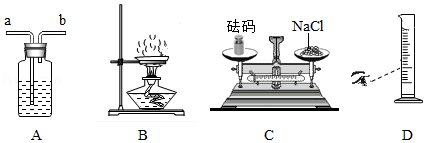
(1)用图A装置干燥O2,广口瓶内盛放的试剂是 ,气体应从 (填“a”或“b”)口进入.
(2)图B是蒸发食盐水操作,缺少的仪器是 ,组装该装置时,放置仪器的先后顺序是 (填数字序号).
①铁架台 ②铁圈 ③蒸发皿 ④酒精灯
(3)配制一定溶质质量分数的氯化钠溶液,图C中称量操作的错误之处是 .若其他操作均正确,按图D所示量取蒸馏水,则配制的氯化钠溶液浓度会 (填“偏大”“偏小”或“无影响”).
工业上常利用石灰浆[主要成分为Ca(OH)2]制备化工原料KClO3的流程如下:

已知:①反应1为:6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O.
②有关物质在常温下的溶解度如下:
物质 |
Ca(ClO3)2 |
CaCl2 |
KClO3 |
KCl |
溶解度/g |
209.0 |
74.5 |
7.3 |
34.0 |
回答下列问题:
(1)在实验中两次涉及过滤操作,完成此操作需要的玻璃仪器有烧杯、玻璃棒、 ,该操作中玻璃棒的作用是 .
(2)Ca(ClO3)2的名称是 .对于反应1,参加反应的Cl2中有一部分Cl的化合价升高,另一部分降低,则化合价升高的Cl与化合价降低的Cl 的个数比为 .
(3)反应2为KCl与Ca(ClO3)2发生的复分解反应,该反应能发生的主要原因是 .溶液A中含有的溶质为CaCl2和 (填化学式).
(4)上述流程中析出的KClO3晶体表面通常吸附有Ca2+、Cl﹣等杂质离子,过滤时洗涤KClO3晶体,应选用下列中的 饱和溶液(填编号).
A.KCl B.CaCl2 C.KClO3 D.Na2CO3.