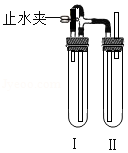
某班级同学分组进行碳的性质实验,并回收实验后的固体制取胆矾。

①按图1进行碳和氧化铜反应的实验,观察到试管中出现 色固体;烧杯中澄清石灰水变浑浊的化学方程式是 。碳与氧化铜的反应中,表现出还原性的物质是 (选填"碳"或"氧化铜")。
②上述实验结束后,回收各小组试管内的固体残渣,并以此为原料(固体A)制取胆矾。为将其中的铜元素全部转化到硫酸铜中,有关实验设计如图2。
Ⅰ.回收得到的固体A中可能含有铜、碳、氧化铜。请根据①中的实验,写出A中可能含有氧化铜的一个原因 等 。
Ⅱ.胆矾的化学式是 。
Ⅲ.溶液B中溶质主要是硫酸铜。请将"固体A"转化为"溶液B"所需的实验步骤补充完整 (在各步骤中须写明所用试剂及进行的操作)。
氢氧化亚铁是白色难溶于水的物质,若接触到空气迅速被氧化,转化成红褐色的氢氧化铁。化学反应方程式为:4Fe(OH) 2+O 2+2H 2O=4Fe(OH) 3,某化学兴趣小组利用实验室提供的药品:铁屑、稀硫酸、氢氧化钠溶液以及如图装置进行实验,观察到产生了白色的氢氧化亚铁沉淀。请回答下列问题:
(1)对于反应4Fe(OH) 2+O 2+2H 2O=4Fe(OH) 3,它的化学反应基本类型是 ,其中化合价升高的元素为 。(写元素名称)
(2)配制药品的蒸馏水需要加热煮沸,解释原因 。
(3)实验得到氢氧化亚铁涉及到的化学方程式有:
①Fe+H 2SO 4═FeSO 4+H 2↑
② 。(写出化学方程式)
(4)试管Ⅰ中加入的药品为 ,试管Ⅱ中加入的药品为 。(均写名称)
(5)请将缺少的实验步骤补全:如图连接好仪器→检查装置气密性→装入药品迅速塞紧塞子→打开止水夹→ ,很快观察到白色沉淀在 试管中产生(填"Ⅰ"或"Ⅱ")。
根据如图回答下列问题:

(1)图B中标有序号①的仪器名称是 .
(2)组装好气体发生装置后,先应该检查装置的 ,然后再添加药品.
(3)欲收集密度比空气大的气体,应该选择的装置是 (填序号).
(4)实验室用石灰石与稀盐酸反应制取二氧化碳的化学方程式是 .
CaH2(氢化钙)是野外作业常用的生氢剂。某实验小组查阅资料后设计如图装置制备CaH2.(夹持装置已略去)
已知:①在加热条件下,Ca与H2反应生成CaH2
②Ca、CaH2都易与水反应生成Ca(OH)2和H2
③碱石灰的主要成分是CaO和NaOH

回答下列问题:
(1)装置B中浓硫酸的作用是 。装置D中碱石灰的作用是 。
(2)实验步骤:先检验装置的气密性,装入药品后打开A中分液漏斗活塞,此后实验步骤的正确顺序是 (注:多余气体的处理不在本实验步骤中体现)。
①加热一段时间;
②在D出口处收集气体检验其纯度;
③关闭A中分液漏斗活塞;
④停止加热,充分冷却;
(3)制备实验结束后,有同学取出试管中的少量固体加入水,立即有大量气泡产生,固体溶解,向所得溶液中加入酚酞试液,溶液变为红色,该同学认为得到的固体全部是CaH 2.小组其他同学认为他的结论不一定正确,理由是 。
某课外兴趣小组设计利用废旧干电池中的锌皮和未知浓度的稀盐酸制取纯净、干燥的氢气,并验证气体中是否含有杂质.实验装置图如图:

【查阅资料】无水硫酸铜遇水变蓝色
(1)装置 A 中仪器①的名称是 ; 写出发生反应的化学方程式 .
(2)实验中看到 B 中无水硫酸铜变蓝色,说明产生的气体中含有杂质水.为了检验气体中还可能存在的杂质,可将 E 装置连接到上述装置 ( 填序号) 之间,气体从 (填 a 或 b)进入装置 E.
(3)D 装置中的试剂是 ( 写出名称).
(4)下列收集氢气的方法中符合题意的是 .
A.排水法B.向下排空气法 C.干瘪的塑料袋 D.塑料瓶.
氯化亚铁具有独特的脱色能力,广泛用于印染、造纸等行业.某课题小组设计如下方案制备氯化亚铁.
已知:①氯化铁易与水反应;②在加热条件下,氢气能与氯化铁反应生成FeCl2和HCl.
③碱石灰中含有CaO与NaOH
小组同学设计下列装置制备少量氯化亚铁(装置不能重复使用).

回答下列问题:
(1)实验开始前应先检验装置的气密性.请叙述检验装置A气密性的方法:关闭活塞, .
(2)气流从左至右,装置接口连接顺序是:a→ → → → →d
(3)装置D中发生反应的化学方程式是 .
(4)装置C中碱石灰的作用是防止空气中的水蒸气进入和 .
(5)实验过程中,在点燃装置D中的酒精灯之前,从安全角度考虑必须要进行的操作是 .
实验是进行科学探究的主要方法。如图是初中化学常见装置,请回答:

(1)仪器①的名称是 。
(2)实验室用纯净物制取O 2的化学方程式是 。
(3)欲用活泼金属与稀硫酸反应制取干燥的H 2,请从这些装置中选择并连接一套组合装置,按照气流从左到右的流向,写出所选装置接口的连接顺序: 。
(4)在实验室,小宇同学为验证CO 2的性质,将制取的气体通入澄清石灰水中,发现澄清石灰水不变浑浊,分析其中的原因可能是 。
如图是实验室常用气体制备装置,据图回答问题:

(1)用A装置制取氧气的化学方程式是 。选择D装置收集氧气是因为 。将带火星的木炭深入盛有氧气的集气瓶中,木炭剧烈燃烧,发出白光,说明氧气能 ,该反应的化学方程式为 。
(2)实验室制取氨气:Ca(OH)2(固)+2NH4Cl(固) CaCl2(固)+2H2O+2NH3↑,要制取并收集干燥的氨气,所选装置正确的连接顺序是 → → (填字母代号)。
CaCl2(固)+2H2O+2NH3↑,要制取并收集干燥的氨气,所选装置正确的连接顺序是 → → (填字母代号)。
(3)为探究氨气的性质,按如图装置进行实验。观察到黑色粉末变红,白色无水硫酸铜变蓝,同时反应中还有一种气体单质生成。

【查阅资料】Cu2O是红色,易与稀硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O。
【提出问题】得到的红色物质是什么?
【猜想】①是Cu;②是Cu2O;③是 。
若猜想①成立,玻璃管中发生反应的化学方程式为 ,说明NH3具有 性。
【设计实验】请你设计一个简单的实验来验证红色物质中是否存在Cu2O: 。