某KCl固体样品中含有少量CaCl2杂质,实验室提纯氯化钾的流程如图。(氯化钾溶解度受温度影响较小)

(1)沉淀a是 。
(2)操作I是 。
①冷却热饱和溶液 ②蒸发结晶
(3)若KC1固体样品中还含有少量杂质K2SO4,小科认为提纯该样品只要在上述方案基础上增加一步实验:在“加入过量K2CO3溶液”与“过滤”操作之间,加过量的硝酸钡溶液。小江认为这种方案不合理,会导致所得KC1固体中含有新的杂质,新杂质是 。
实验室有一份氯化钠和氯化钡混合物样品。兴趣小组同学设计了如下实验方案,分离提纯氯化钠并测定样品中氯化钠的质量百分含量,请回答下列问题:

(1)用托盘天平称量样品前对天平进行的第一步操作是 。
23溶液的目的是 。该小组同学用如图所示装置进行操作Ⅱ,请指出操作中存在的两处错误: 、 。

(3)下列关于操作Ⅲ的说法正确的是 (填序号)。
a.该操作中用到的玻璃仪器有酒精灯、玻璃棒、蒸发皿
b.该操作中用玻璃棒不断搅拌的目的是防止局部温度过高,造成液滴飞溅
c.当蒸发皿中出现较多固体时,停止加热
d.停止加热后,立即将蒸发皿直接放在试验台上。
(4)样品中氯化钠质量百分含量为 。
根据不同物质的性质,提纯物质的方法可以由多种.下面呈现的是化学课堂上"物质提纯"的小组竞赛场景.
(1)甲组抽到的题目是"从30gNaCl和2gKNO 3的混合物种提纯NaCl".同学们经研究认为依据两物质的溶解度曲线,可采用如下物理方法来提纯.

上述两固体 (填"能"或"不能")全部溶解,操作m的名称是 ,蒸发结晶后得到NaCl的质量 30g(填"大于"、"小于"或"等于").
甲组一位同学问道:"能否用降温结晶的方法从上述溶液a中析出KNO 3,从而达到分离的目的?"请你判断此方法是否可行,并说出理由 .
(2)乙组抽到的题目是"从NaCl和Na 2CO 3的混合物中提纯NaCl".同学们经过讨论认为利用两物质化学性质的差异,可采用如下化学方法来提纯.

如图3中X的化学式为 .由于BaCl 2溶液的用量不易控制,会使溶液b的溶质有多种情况,导致蒸发后得到的固体可能不纯.
(3)同学们对乙组方案中溶液b的溶质成分进行探究.
【作出猜想】猜想一:NaCl、BaCl 2猜想二:NaCl 猜想三: .
【设计方案】经讨论,大家认为只用一种试剂就能作出判断.
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量溶液b于试管中, 向其中加入 |
若看到 |
猜想一正确 |
| 若无明显现象 |
猜想二正确 |
|
| 若看到冒出气泡 |
猜想三正确 |
各组依据上述设计方案进行了实验,验证了反应后溶质的确有三种情况.
(4)同学们对甲乙两组提纯方法的效果进行了研讨.
【反思评价】大家认为用物理方法和化学方法都可以实现物质的提纯.用化学方法提纯还要考虑到反应物用量对提纯效果的影响.
【拓展提升】老师说:"合理选择试剂,用化学方法可以从NaCl和Na 2CO 3的混合物中提纯NaCl,方法是向混合物中加入过量的 ,充分反应后,经蒸发结晶就能得到NaCl."
为除去氯化钠中的泥沙和CaCl2、MgCl2、Na2SO4杂质,某化学兴趣小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按以下流程进行实验探究。

(1)溶解、过滤、蒸发操作中都要用到的一种玻璃仪器是 。
(2)写出一个加入Na2CO3溶液时所发生反应的化学方程式 。
(3)上述流程中,若将过滤和加盐酸的操作顺序颠倒,所得精盐产品中含哪些杂质?(BaSO4不溶于水,也不溶于酸)
掌握科学的研究方法,探索化学世界的奥秘.
(1)分类是学习化学的重要方法之一.
①生活中,常会接触到下列物质:
A.铜丝 B.甲烷 C.过氧化氢 D.碘酒
其中属于混合物的是(填字母,下同) ,属于氧化物的是 .
②根据物质在转化过程中的特点,可将化学反应分为化合反应,分解反应、置换反应和复分解反应四种基本反应类型,下列转化不属于这四种基本反应类型的是 .
A.生石灰与水反应 B.一氧化碳还原氧化铁 C.中和反应
(2)实验是学习化学的一条重要途径,实验室中可用KClO 3在MnO 2催化下受热分解制取氧气,并将反应后的混合物进行分离回收,实验操作如图所示(MnO 2难溶于水)

①图A中试管口略向下倾斜的原因是 ,图B操作中玻璃棒的作用是 .
②图C操作中的一处明显错误是 ,图D操作中,当看到 ,停止加热.
(3)质量守恒定律是帮助我们学习的认识化学反应实质的重要理论.
①下列表述正确的是
A.蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律
B.每32g S和32g O 2完全反应后,生成64g SO 2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②有机化合物R与足量氧气置于密闭容器中充分反应生成CO 2和H 2O,实验测得反应前后物质的质量如下表:
| |
R |
O 2 |
CO 2 |
H 2O |
| 反应前质量/g |
46 |
128 |
0 |
0 |
| 反应后质量/g |
0 |
32 |
x |
54 |
则x= ,已知参加反应的物质R与氧气的分子个数之比为1:3,则R的相对分子质量是 .
实验室中有一包由KCl、MgSO4和CaCl2组成的固体混合物,某校研究性学习小组的同学为了除去其中的MgSO4和CaCl2,得到纯净的KCl,设计如下实验方案.
请你回答下列问题:
(1)X溶液与Ba(OH)2溶液反应的化学方程式是 ,该反应的基本反应类型是 .
(2)Y溶液中溶质的化学式是 .
(3)该实验中盐酸的作用是 .
NaCl、CaCl 2的部分溶解度数据见下表。
| 温度(℃) |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度 (g/100g水) |
NaCl |
36.0 |
36.6 |
37.1 |
38.0 |
39.2 |
| CaCl 2 |
27.6 |
39.8 |
41.4 |
43.2 |
45.2 |
|
①由上表可知:20℃时,NaCl的溶解度是 g/100g水;60℃时,溶解度相对较大的物质是 。
②某NaCl固体中含有CaCl 2杂质,分别取样进行实验。
【测定杂质含量】
取10.0g样品溶于水,加入足量Na 2CO 3溶液,与CaCl 2反应生成NaCl和0.01mol CaCO 3沉淀,计算样品中CaCl 2的质量。(根据化学方程式列式计算) 。
【提纯NaCl】取30g样品,依据两种物质的溶解度差异设计实验并提纯NaCl。
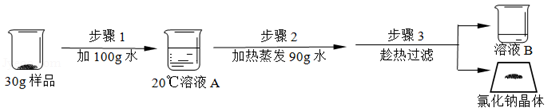
Ⅰ.溶液A是NaCl的 (选填"饱和"或"不饱和")溶液;
Ⅱ.溶液A中CaCl 2的质量分数 (选填"大于""小于"或"等于")溶液B中CaCl 2的质量分数;
Ⅲ.为达成实验目的,上述三个步骤在试剂用量、实验操作等方面都有综合考虑,请写出其设计意图 。