某课外活动小组设计了以下实验验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
(1)测定硝酸的物质的量反应结束后,从如图装置B中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为______ mol,则Ag与浓硝酸反应过程中生成的NO2在标准状况下的体积为___________mL。
(2)测定NO的体积
①从如图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是_______。
②选用如图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是__________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中______(填“有”或“没有”)NO产生,作此判断的依据是_________。
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是 ;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为 ;装置D中反应生成NaClO2的化学方程式为 ;反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有的一种阴离子是 ;检验该离子的方法是 ;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;② ;③ ;④ 得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+4I-+4H+=2H2O+2I2+Cl-,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol•L-1 Na2S2O3标准液滴定至终点,测得消耗标准液体积的平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。请计算所称取的样品中NaClO2的物质的量为 。
锗及其化合物被广泛应用于半导体、催化剂等领域。以铅锌矿含锗烟尘为原料可制备GeO2,其工艺流程图如下。

已知:GeO2是两性氧化物;GeCl4易水解,沸点86.6℃
(1)第①步滤渣主要成分有 (填化学式),实验室萃取操作用到的玻璃仪器有 。
(2)第②步萃取时,锗的萃取率与V水相/V有机相(水相和有机相的体积比)的关系如下图所示,

从生产成本角度考虑,较适宜的V水相/V有机相的值为 。
(3)第④步加入盐酸作用 (答两点即可)。
(4)第⑤步反应的化学方程式 。
(5)检验GeO2·nH2O是否洗涤干净的操作是 。
“8.12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 ( 25℃) |
Ki=1.77×10-4 |
Ki=5.0×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)NaCN溶液呈碱性的原因是 (用离子方程式表示)
(2)下列选项错误的是
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
(3)H2O2有有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-) c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验。将CN-的浓度为0.2000 mol/L的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。

已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl-
2CNO-+2H+ + 3C1O-=N2↑+2CO2↑+ 3C1-+H2O
(5)①和⑥的作用是 。
(6)反应结束后,缓缓通入空气的目的是 。
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置 反应前后的质量(从装置①到⑥中选择,填装置序号)。
海水中含有丰富的镁资源。锂(Li)与镁元素性质相似。
(1)某同学设计了从模拟海水中制备MgO的实验方案:

| 模拟海水中的 离子浓度(mol/L) |
Na+ |
Mg2+[来 |
Ca2+ |
Cl― |
HCO3―[来源 |
| 0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12
请回答:沉淀物X为 (写化学式);滤液N中存在的金属阳离子为 ;
步骤②中若改为加入 4.2 gNaOH固体,沉淀物Y为 (写化学式)。
(2)物质的量为0.10 mol的锂在只含有N2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是 ;
(3)锂电池是新一代高能电池,目前已研究成功多种锂电池。某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6 CoO2+LiC6,则放电时电池的正极反应为 ;
CoO2+LiC6,则放电时电池的正极反应为 ;
(4)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量AI、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为 。
②调整PH=5-6的目的是 。
近年来,铝在汽车、航天、机械制造、军事等产业中应用迅猛发展。
(1)铝元素的离子结构示意图为 ;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式 ;在电解过程中 极(填“阴”或“阳”)需要定期补充。
(2)铍(Be)与铝元素相似,其氧化物及氢氧化物具有两性
①请写出Be(OH)2溶于NaOH溶液的化学方程式为: ;
②往10.0mL1.00 mol/L的Be(NO3)2溶液中逐滴加入等浓度的NaOH溶液,请在以下坐标图中画出沉淀量随NaOH溶液加入量的变化图:

某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程:
下列说法不正确的是
| A.溶解烧渣选用足量硫酸,试剂X选用铁粉 |
| B.固体1中一定含有SiO2;控制pH是为了使Al3+转化为Al(OH)3,进入固体2 |
| C.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O |
| D.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 |
向Fe(NO3)3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是
| 氢氧化物 |
溶液PH |
|||
| 开始沉淀 |
沉淀完全 |
沉淀开始溶解 |
沉淀完全溶解 |
|
| Fe(OH)3 |
2.3 |
3.4 |
— |
— |
| Al(OH)3 |
3.3 |
5.2 |
7.8 |
12.8 |

A.OA段产生的沉淀为BaSO4和Fe(OH)3
B.据图计算原溶液中c(NO3-)=c(SO42-)
C.AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4+Al(OH)3
D.C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2- + 2H2O = Al(OH)3 + OH一
A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素,已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又如A、C两元素原子序数之和是B、D两元素原子序数之和的 。 请回答下列问题
。 请回答下列问题
(1)写出由B、C两种元素形成的原子个数比为1:1的化合物的电子式:________,其晶体中所含化学键的类型有________。
(2)A2B与A2D的沸点:A2B________A2D(填“高于”或“低于”),其原因是___________。
(3)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式:___________。
(4)碳元素的一种同位素可测定文物年代,这种同位素的符号是______。H2O2的化合物类型是_______(填“共价化合物”或“离子化合物”)。
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。按照实验步骤依次回答下列问题:
(1)导线中电子流向为____________(用a、b表示)。
(2)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________ (用“NA”表示) ;
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
| A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动 |
| B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动 |
| C.盐桥中的K+、Cl-都向左侧烧杯移动 |
| D.盐桥中的K+、Cl-几乎都不移动 |
(4)若将反应2Fe3++Cu===Cu2++2Fe2+设计成原电池,写出电极反应式。
正极反应_____________;
(5)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
①电池总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag:__________。
②2C2H2+5O2 4CO2+2H2O:_____________。
4CO2+2H2O:_____________。
③6H2O+6CO2  C6H12O6(葡萄糖)+6O2:__________。
C6H12O6(葡萄糖)+6O2:__________。
I .含碳原子数最少且存在同分异构体的烷烃的分子式是_____,其同分异构体的结构简式是________。
II.从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:_______,反应类型:________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
III.已知乙烯能发生以下转化: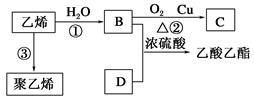
(1)C中含官能团名称_________;
(2)写出反应的化学方程式及反应类型:
B与D反应的化学方程式__________________;反应类型:________。
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得。实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75∶2);②在碳存在下,X与N2反应生成AlN。请回答:
(1)X的化学式为 。
(2)碳热还原制备氮化铝的总反应化学方程式为:
Al2O3(s)+3C(s)+N2(g) 2AlN(s)+3CO(g)
2AlN(s)+3CO(g)
①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如下图曲线甲所示。下列说法不正确的是 。

A.从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率
B.c点切线的斜率表示该化学反应在t时刻的瞬时速率
C.在不同时刻都存在关系:v(N2)=3v(CO)
D.维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙
②一定温度下,在压强为p的反应体系中,平衡时N2的转化率为α,CO的物质的量浓度为c;若温度不变,反应体系的压强减小为0.5p,则N2的平衡转化率将 α(填“<”、“=”或“>”),平衡时CO的物质的量浓度 。
A.小于0.5c B.大于0.5c,小于c
C.等于c D.大于c
③该反应只有在高温下才能自发进行,则随着温度升高,反应物Al2O3的平衡转化率将 (填“增大”、 “不变”或“减小”),理由是 。
(3)在氮化铝中加入氢氧化钠溶液,加热,吸收产生的氨气,进一步通过酸碱滴定法可以测定氮化铝产品中氮的含量。写出上述过程中氮化铝与氢氧化钠溶液反应的化学方程式 。
某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱(Na2CO3)和氯化铵(NH4Cl)。
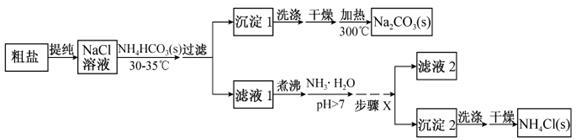
已知盐的热分解温度:NH4HCO3 36℃;NaHCO3 270℃;NH4Cl 340℃;Na2CO3>850℃
请回答:
(1)从NaCl溶液到沉淀1的过程中,需蒸发浓缩。在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3固体之后,其原因是 。
(2)为提高NH4Cl产品的产率和纯度,需在滤液1中加入氨水,理由是 ;步骤X包括的操作有 。
(3)测定NH4Cl产品的纯度时,可采用的方法:在NH4Cl溶液中加入甲醛使之生成游离酸(4NH4Cl+6HCHO=(CH2)6N4+4HCl+6H2O),然后以酚酞为指示剂,用NaOH标准溶液(需用邻苯二甲酸氢钾基准物标定)进行滴定。
①下列有关说法正确的是 。
| A.为了减少滴定误差,滴定管、锥形瓶均须用待装液润洗 |
| B.标准NaOH溶液可以装入带有耐腐蚀旋塞的玻璃滴定管中 |
| C.开始滴定前,不需擦去滴定管尖悬挂的液滴 |
| D.三次平行测定时,每次需将滴定管中的液面调至“0”刻度或“0”刻度以下的附近位置 |
②若用来标定NaOH标准溶液的邻苯二甲酸氢钾基准物使用前未烘至恒重,则测得NH4Cl产品的含量比实际含量 (填“偏大”、“偏小”或“无影响”)。
三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]•3H2O可用于摄影和蓝色印刷.可用如下流程来制备.

根据题意完成下列各题:
(1)若用铁和稀硫酸制备FeSO4•7H2O, (填物质名称)往往要过量.
(2)要从溶液中得到绿矾,必须进行的实验操作是 (按前后顺序填).
a.过滤洗涤
b.蒸发浓缩
c.冷却结晶
d.灼烧
e.干燥
某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成
二氧化碳,同时,MnO4-.被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过
滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-,
被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液19.98ml;
(3)配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;主要操作步骤依次是:称量、 、转移、 、定容、摇匀.
(4)加入锌粉的目的是 .
(5)实验测得该晶体中铁的质量分数为 .在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量 .(选填“偏低”“偏高”“不变”)
(6)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体.研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式 .
草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:

已知:①Ksp(CaF2)=1.46×10﹣10,Ksp(CaC2O4)=2.34×10﹣9。
②相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为0.1mol•L﹣1计算).
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Al3+ |
3.0 |
5.0 |
| Ni2+ |
6.7 |
9.5 |
(1)“粉碎”的目的是 。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图。“酸浸”的适宜温度与时间分别为 (填字母).

a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是 ,将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是 。
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为 ,第2步中加入适量NH4F溶液的作用是 。
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式: 。
(6)已知废镍催化剂中镍的质量分数为5.9%,则100kg废镍催化剂最多可制得 kg草酸镍晶体。(Ni:59,C:12,H:1,O:16)