醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为:

醋硝香豆素可以通过以下方法合成(部分反应条件省略)。

已知: + H2O
+ H2O
回答以下问题:
(1)反应的反应类型是 。
(2)从A到B引入的官能团名称是 。
(3)反应‚的化学方程式为 。
(4)反应ƒ的化学方程式为 。
(5)关于E物质,下列说法正确的是 (填字母序号)。
a.在核磁共振氢谱中有四组吸收峰
b.可以用酸性高锰酸钾溶液鉴别D和E
c.可以发生加成反应、聚合反应、氧化反应和还原反应
d.存在顺反异构
(6)写出G的结构简式 。
(7)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有 种。
可与氯化铁溶液发生显色反应;
‚可与碳酸氢钠溶液反应生成二氧化碳气体。
其中,苯环上的一氯代物只有两种的同分异构体的结构简式为 。
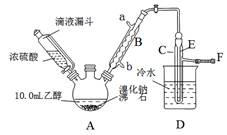
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr  NaHSO4+HBr↑
NaHSO4+HBr↑
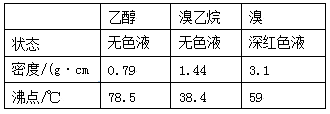
CH3CH2OH+HBr CH3CH2Br+H2O。有关数据见下表:
CH3CH2Br+H2O。有关数据见下表:
(1)A装置的名称是 。
(2)实验中用滴液漏斗代替分液漏斗的优点为 。
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式 。
(4)给A加热的目的是 ,F接橡皮管导入稀NaOH溶液,其目的主要是 。
(5)图中C中的导管E的末端须在水面以下,其目的是 。
(6)为了除去产品中的主要杂质,最好选择下列____________(选填序号)溶液来洗涤所得粗产品
| A.氢氧化钠 | B.碘化钾 | C.亚硫酸钠 | D.碳酸氢钠 |
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0 g。
①在上述提纯过程中每次分液时产品均从分液漏斗的___________(上口或下口)取得。
②从乙醇的角度考虑,本实验所得溴乙烷的产率是____________。
如下对甲、乙、丙三种物质的说明:

(1)甲中含氧官能团的名称为 。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):

其中反应Ⅰ的反应类型为 ,反应Ⅱ的化学方程式为 (注明反应条件)。
(3)已知:

由乙制丙的一种合成路线图如下(A﹏F均为有机物,图中Mr表示相对分子质量):

① 下列物质不能与C反应的是 (选填序号)
a. 金属钠 b.HBr c.Na2CO3溶液 d. 乙酸
② 写出F的结构简式
③ D有多种同分异构体,其中一种既能发生银镜反应又能发生水解反应的结构简式 其
④综上分析,丙的结构简式为
铜、铁及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应(已知1 molCu2S失去10mol的电子),写出该反应的离子方程式 。
(2)工业上利用废铜屑、废酸(含硝酸、硫酸)为主要原料制备硫酸铜晶体。某含有c(HNO3)="2" mol·L—1,c(H2SO4)="4" mol·L—1的废酸混合液100 mL(不含其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4·5H2O)的质量为 。
(3)现有一块含有铜绿的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。(已知:金属生锈率= )
)
①上述铜片中铜的生锈率为 (结果保留2位有效数字)
②固态铜与适量氧气反应,能量变化如下图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式 。

(4)高铁酸盐在能源环保等领域有广泛用途,如高铁酸钾(K2FeO4) 因有强氧化性,能杀菌消毒,产生Fe(OH)3有吸附性,是一种新型净水剂,用如下图所示的装置可以制取少量的高铁酸钾。
(已知爱迪生蓄电池的反应式为: )
)

①爱迪生蓄电池的负极材料是
②写出制取高铁酸钾阳极的电极反应式
③当生成19.8g的K2FeO4时,隔膜两侧电解液的质量变化差(△m右一△m左)为_ g。
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0[ |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式_______________ _。
(2)写出NaClO3发生反应的主要离子方程式________________ ___;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______ __。
(3)“加Na2CO3调pH至a ( a="6" )”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是______ ___、_______ ___和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是____________ __。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取 剂的目的是___ ___;其使用的最佳pH范围是___________。
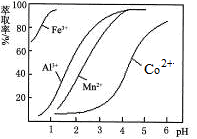
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:

(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是: 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L。实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
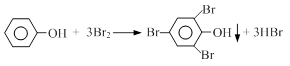
①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5 mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡。
步骤4: ,再用0.01 mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15 mL。(反应原理:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6)
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg/L。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 。(填“偏高”、“偏低”或“无影响”)。
利用芳香烃X和烯烃Y可以合成紫外线吸收剂BAD。
已知:G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程为引入羧基(—COOH)的反应。其中BAD结构简式为:
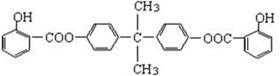
BAD的合成路线如下:

试回答下列问题:
(1)写出结构简式:Y ,D 。
(2)上述属于取代反应的有 (填数字序号)。
(3)1molBAD最多可与含 molNaOH的溶液完全反应。
(4)写出下列反应的化学方程式,注明反应条件:反应④
B+E
(5)E有多种同分异构体,判断符合下列要求的同分异构体数目为 种。
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③核磁共振氢谱图中有四个吸收峰
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹。
(1)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定。工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式 。
(2)一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:

①净化N2和H2时,铜屑的作用是: ;硅胶的作用是 。
②在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度 ;体系中要通入适量的氢气是为了 。
③X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(3)工业上可以通过如下图所示的流程制取纯硅:

①整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应,写出该反应的化学方程式 。
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%。则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
Methylon(l,3-亚甲基双氧甲基卡西酮)的一种合成路线如下:
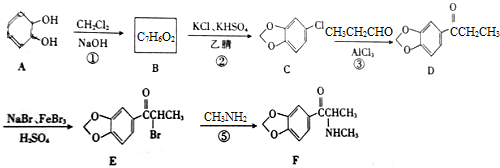
(1)A的分子式为 ;B的结构简式为 。
(2)D中含氧官能团的名称为______________。
(3)反应⑤的反应类型是____________。
(4)B的同分异构体中能同时满足下列条件的共有 种(不含立体异构)。
a.属于芳香族化合物 b.能与NaOH溶液反应 c.结构中除苯环外不含其他环状结构
其中核磁共振氢谱显示只有4组峰,且不能发生银镜反应的同分异构体是 (填结构简式)。
(5)参照上述Methylon的合成路线并结合已学知识,设计一种以苯和乙醛为原料制备香料2羟基苯乙酮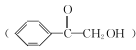 的合成路线。
的合成路线。
碱式碳酸铜[CuCO3·Cu(OH)2]是一种用途广泛的化工原料,可用于作有机催化剂、颜料制造、原油贮存时脱碱等。用废杂铜(主要成分为Cu,还含有少量杂质Fe)制取碱式碳酸铜的工艺流程如图所示。
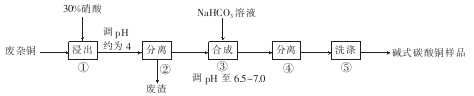
(1)步骤①浸出时,硝酸浓度不易过大,其原因是____。
(2)步骤②分离前需将溶液pH调节在4左右,其目的是 ,所得废渣的主要成分为____________。
(3)步骤③合成时,采用将NaHCO3溶液迅速投入Cu(NO3)2溶液中,其主要原因是 ;合成时发生反应的化学方程式为____________。
(4)本实验中两次用到固液分离,本实验中最适合固液分离的设备是____________。
(5)步骤⑤洗涤主要除去的杂质离子是 。
(6)准确称取所得产品m g,放入碘量瓶中,加入2 g KI及5 ml3 mol/L稀硫酸(两试剂均过量)摇匀并静置10 min(2Cu2++4I-=2CuI↓+I2),再加入2 mL淀粉溶液,用c mol/L的Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),到滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜元素的质量分数为________。
锰的化合物是优良的催化剂,可用于干电池原料生产等。
(1)锌锰干电池的反应为2MnO2 +Zn+2NH4Cl ="2" MnO(OH) +Zn(NH3)2Cl2,MnO(OH)中锰元素的化合价为____。
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为 (填化学式)。[已知Ksp(MnS)=1.4×10-1 5,Ksp(ZnS)=2.9×10 -25,Ksp(FeS)=6.0×10-18]
(3) Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g) △H1,其反应机理如下:
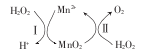
①已知反应Ⅱ为MnO2(s)+H2O2(1) +2H+( aq)=Mn2+(aq) +O2(g)+2H2O(1) △H2。写出反应I的热化学方程式(焓变用△H1和△H2表示): 。
②某温度时,向10 mL0.4 mol.L-1 H2O2液中滴入1滴MnSO4发生分解:2H2O2 =2H2O+O2,测得不同时刻生成O2的体积(已折算为标准状况下的体积)如下表:

0~2 min时反应速率比2~4 min时的快,其原因是_________;
0~6 min的平均反应速率v(H2O2)= (忽略溶液体积的变化)。
(4)锰基催化剂是合成甲醇、二甲醚的催化剂。已知:

①反应I的正反应是 (填“放热”或“吸热”)反应。
②反应Ⅱ的平衡常数表达式为 。
磷及其化合物的应用非常广泛,以废铁屑等为原料合成磷酸亚铁锂的前驱体的制备流程如下:
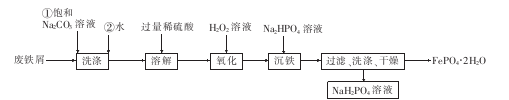
回答下列问题:
(1) H2 O2的电子式为 ;Na2HPO4,的电离方程式为_____________。
(2)废铁屑要用热的Na2CO3溶液洗涤的目的是_____________。
(3)为了加快铁屑的溶解速率,除适当增大硫酸的浓度外,还可采取的措施是 (任写一种);氧化时H2O2作 (填“氧化剂”或“还原剂”)。
(4)沉铁时,溶液中的Fe3+与HPO42-反应生成FePO4·2H2O沉淀的离子方程式为 。
(5) FePO4与Li2CO3及C在高温条件下生成LiFePO4和CO的化学方程式为 ;高温成型前,常向LiFePO4中加入少量活性炭,其作用是可以改善成型后LiFePO4的导电性能和__________。
有机物Ⅰ可以用E和H在一定条件下合成如图:

请根据以下信息完成下列问题:
①A为丁醇且核磁共振氢谱有2种不同化学环境的氢;
②R﹣CH=CH2 R﹣CH2CH2OH
R﹣CH2CH2OH
③一个碳原子上连有两个羟基不稳定,易脱水形成羰基.
(1)B的分子式为: .
(2)C→D、G→H的反应类型为 、 .
(3)芳香族化合物F的分子式为C7H8O,苯环上的一氯代物只有两种,则F的结构简式为: .
(4)D生成E的化学方程式为 .E与H反应生成I的方程式为 .
根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是 (填写序号)
a.H3O+ b.H2O c.NO2+ d.NO2﹣
(2)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为 .P可形成H3PO4、HPO3、H3PO3等多种酸,则这三种酸的酸性由强到弱的顺序为 (用化学式填写)
(3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子(价电子)排布式为 Q2+的未成对电子数是 .
(4)如图1是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图象是图1中的 .
(5)[Cu(NH3)4]2+配离子中存在的化学键类型有 (填序号).
①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键,
若[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl﹣取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 (填序号)
①平面正方形②正四面体③三角锥形④V形.
(6)X与Y可形成离子化合物,其晶胞结构如图2所示.其中X和Y的相对原子质量分别为a和b,晶体密度为ρg/cm3,则晶胞中距离最近的X、Y之间的核间距离是 cm(NA表示阿伏伽德罗常数,用含ρ、a、b、NA的代数式表达)

某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O2等物质)为原料制取Zn和MnO2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:

(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按图1的工业流程进行处理得到溶液(Ⅳ)、电解溶液(Ⅳ)即得MnO2和Zn.
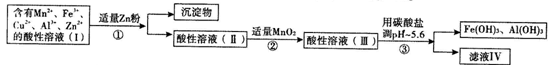
a.操作中①中加Zn粉后发生反应的离子方程式为: 、 .
b.操作②中加入MnO2的作用是 ;反应的离子方程式是 .
c.操作③中所加碳酸盐的化学式是 .
(3)电解法制备高锰酸钾的实验装置示意图(图中阳离子交换膜只允许K+离子通过):

①阳极的电极反应式为 .
②若电解开始时阳极区溶液为1.0L0.40mol/LK2MnO4溶液,电解一段时间后,溶液中 为6:5,阴极区生成生成KOH的质量为 .(计算结果保留3位有效数字)
为6:5,阴极区生成生成KOH的质量为 .(计算结果保留3位有效数字)
(4)已知25℃时,Ksp[Mg(OH)2]=5.6×10﹣12,Ksp[Cu(OH)2]=2.2×10﹣20,Ksp[Fe(OH)3]=4.0×10﹣38,Ksp[Al(OH)3]=1.1×10﹣33,
①在25℃下,向浓度均为0.1mol•L﹣1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式)
②用MgCl2和AlCl3的混合溶液(A)与过量氨水(B)反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 反应物.
③溶液中某离子物质的量浓度低于1.0×10﹣5mol•L﹣1时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol•L﹣1.此时所得沉淀中 (填“还含有”或“不含有”)Al(OH)3.