高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
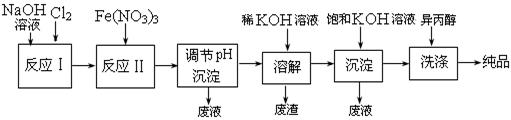
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③进行溶解,沉淀、洗涤这些操作的共同目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为________________。
(3)湿法、干法制备K2FeO4的反应中均利用的是+3价Fe元素的 性质。
(4)高铁电池是正在研制中的可充电干电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 。

辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
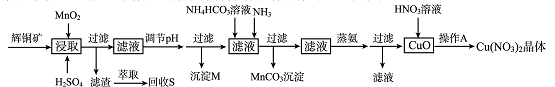
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol.L-1计算)。
| 离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Mn2+ |
8.3 |
9.8 |
| Cu2+ |
4.4 |
6.4 |
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式 。
(2)调节pH的目的是 ,pH的调节范围为_____________。
(3)生成MnCO3沉淀的离子方程式为 。
(4)操作A为 。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2 (g) =2Cu2O(s)+2SO2(g) △H="-" 768.2 kJ.mol-l
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2 (g) △H="+116.0" kJ.mol-l
则由Cu2S与O2加热反应生成Cu的热化学方程式为_____________。
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(NO3)2。假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.0 kg这样的辉铜矿最多能制备 kg无水Cu(NO3)2。
ClO2是一种国际上公认的安全无毒的绿色水处理剂。回答下列问题:
(1)工业废水的处理:
某实验兴趣小组通过右图装置制备ClO2,并用它来处理Wg某T业废水(含Mn2+、CN-等)。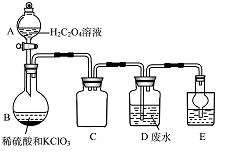
已知:i.ClO2为黄绿色气体,极易溶于水,沸点11℃;
ii.ClO2易爆炸,若用“惰性气体”等稀释时,爆炸性则大大降低;
iii.某T业废水处理过程中Mn2+转化为MnO2、CN-转化为对大气无污染的气体;
iv.装置B中发生的反应为:H2C2O4+H2SO4+2KClO3=K2SO4+2CO2++2C1O2+H2O.
①A装置的名称是 ,C装置的作用为 。
②用H2C2O4溶液、稀硫酸和KC1O3制备ClO2的最大优点是 。
③写出装置D中除去Mn2+的离子方程式 。
④E装置中盛放的试剂可选用 (填标号)。
a.CCl4 b.H2O c.稀盐酸 d.NaOH溶液
(2)废水中CN-含量的测定:
另取工业废水W g于锥形瓶中,加入10 mL0.10 mol/L的硫酸溶液,用0.020 0 mol/L的KMnO4标准溶液进行滴定,当达到终点时共消耗KMnO4标准溶液25. 00 mL。在此过程中:
①使用棕色滴定管的原因是 ,滴定终点的判断依据是________________。
②W g 工业废水中CN-的含量为 mol。
③若滴定管在盛放标准溶液前未用标准液润洗,则测定结果将 (填“偏高”、“偏低” 或“无影响”)。
铁及其化合物与生产、生活关系密切。

(1)右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀的类型为__________腐蚀。
②图中A、B、C三点附近的区域内,腐蚀最严重的是 (填字母)。
(2)已知Fe3+、Fe2+、Cu2+在溶液中沉淀的pH如下表:

印刷电路铜板腐蚀剂常用FeCI3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol.L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:①__ ;② ;③过滤。(提供的药品:Cl2、浓H2S04、NaOH溶液、CuO、Cu)
(3)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
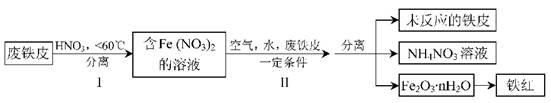
①向Fe(NO3)2溶液中加入稀盐酸,溶液颜色由浅绿色变为棕黄色,该反应的原理为______________(用离子方程式表示)。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,结合流程写出该反应的化学方程式为 。
(4)某铁质容器材料为碳素钢,可盛装冷浓硫酸。取5.60 g该材料放人15.0mL浓硫酸中加热,充分反应后得到溶液X并收集到气体Y。
①甲组通过实验确定了X中含有Fe3+,为检验X中是否还含有Fe2+,可另取X溶液加入 (填序号)。
A.KSCN溶液和氯水 B.K3[Fe(CN)6]溶液
C.NaOH溶液 D.酸性KMnO4溶液
②为分析气体Y中的成分,乙组将560 mL(标准状况)气体Y通入足量溴水,然后向该溶液中加入足量BaCl2溶液,过滤、洗涤、干燥后,称得沉淀质量为2.33 g。则气体Y通入足量溴水反应的离子方程式为____ ,参加该反应的气体在Y中的体积分数为 .
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
资料:氰化钠化学式NaCN(C元素+2价,N元素-3价),白色结晶颗粒、易潮解、有微弱的苦杏仁气味、剧毒、易溶于水、易水解生成氰化氢、水溶液呈碱性。
(1)氰化钠(NaCN)溶液呈碱性,其原因是____________(用离子方程式解释)。
(2)“8.12”爆炸事故后,当地政府组织群众用双氧水喷洒,用双氧水处理NaCN产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式____ 。
某化学兴趣小组在实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过如右图所示装置制备Na2S2O3。

(3)右图a装置中盛装Na2SO3
固体的仪器名称是______________;
b装置的作用是________________。
(4)装置c中的产物有Na2S2O3和C02气体等,实验结束后,装置d中的溶质有NaOH、Na2CO3,还可能有________________________。
(5)实验结束后,在e处最好连接盛______________(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,防止拆除装置时污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。已知:
①废水中氰化钠的最高排放标准为0.50 mg/L。
②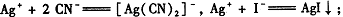 AgI呈黄色,且CN -优先与Ag+反应。
AgI呈黄色,且CN -优先与Ag+反应。
实验如下:
取25.00 mL处理后的氰化钠废水于锥形瓶中并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50 mL。
(6)滴定终点的判断方法是_______________。
(7)处理后的废水中氰化钠的含量为_____________mg/L。
C、N、O、S、Mg、Fe等是中学化学中的常见元素。按要求回答下列问题:
(1)N元素在元素周期表中的位置是______________。
(2) H2S的沸点比H2O的沸点低的主要原因是__________________。
(3)已知:2 SO2(g) +O2(g)- 2 SO3(g) △H="-196.6" kJ·mol-l
2 SO3(g) △H="-196.6" kJ·mol-l
2 NO(g) +O2(g)  2 NO2(g) AH="-113.0" kJ·mol-l
2 NO2(g) AH="-113.0" kJ·mol-l
则反应NO2(g) +SO2(g)  SO3(g)+NO(g)的△H= kJ·mol-l
SO3(g)+NO(g)的△H= kJ·mol-l
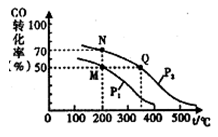
(4)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2 H2(g)  CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为 ;Pl P2(填“>、<或=”);平衡常数KM=__________。
CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为 ;Pl P2(填“>、<或=”);平衡常数KM=__________。
(5) Mg和Fe组成的合金是目前已发现的储氢密度最(高的储氢材料之一,其晶胞结构如图甲(白球代表Mg,黑球代表Fe)。则该合金的化学式为 。若该合金用M表示,某种储氢镍电池(MH - Ni电池)的结构如图乙所示。其电池反应为:MH+NiOOH Ni( OH)2 +M。下列有关说法不正确的是________。
Ni( OH)2 +M。下列有关说法不正确的是________。
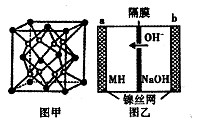
A.放电时正极反应为:NiOOH+H2O+e-= Ni(OH)2 +OH-
B.放电时电子由b极到a极
C.充电时负极反应为:MH+ OH- - e-= H20+M
D.M的储氢密度越大,电池的比能量越高
[化学——选修5:有机化学基础]
有机化合物J是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。其中一种合成路线如下:

已知:
①A既能发生银镜反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱显示有4种氢,且峰面积之比为1︰2︰2︰1。②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平。
③
回答以下问题:
(1)A中含有的官能团名称是 。
(2)写出有机反应类型B→C ,F→G 。
(3)写出F生成G的化学方程式
(4)写出J的结构简式
(5)E的同分异构体有多种,写出其中一种符合以下要求的E的同分异构体的结构简式
①与FeCl3溶液发生显色反应 ②能发生银镜反应
③苯环上只有两个对位取代基 ④能发生水解反应
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。

①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.c ( H2 )减少 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 |
| D.重新平衡c ( H2 )/ c (CH3OH )减小 E.平衡常数K增大 |
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程

①写出阳极电极反应式 。
②请写出除去甲醇的离子方程式 。
A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A 、B 、C 、E
(2)写出①A溶液呈碱性和③的离子方程式:
①
③ _
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是( )

| A.混合酸中NO3-物质的量为0.4mol |
| B.OA段产生的是NO,AB段的反应为: Fe+2Fe3+→3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为5 mol·L-1 |
H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)空气阴极法电解制备H2O2的装置如下图所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物。试回答:

①直流电源的a极名称是 。
②阴极电极反应式为 。
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下室温制得了H2O2。相对于电解法,该方法具有的优点是安全、 。
(2)Fe3+对H2O2的分解具有催化作用。利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。

(3)用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。反应的离子方程式是 ,控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| Cu的平均溶解速率 (×10-3mol·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
【探究一】
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用______(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.KMnO4酸性溶液
②乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:[SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为 。
【探究二】
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。


(3)装置B中试剂的作用是
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于____________(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是__________________
(7)若要测定336mL气体中H2的含量(标准状况下约有28 mL H2),可否用托盘天平称量D或E反应前后的质量差的方法做出判断?并说明理由
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
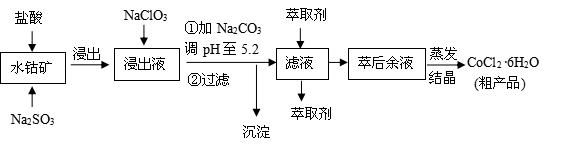
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为 ,加入萃取剂的目的是 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3 溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4= kJ·mol-1。
(2) 使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式: 。
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为: ;为抑制肼的分解,可采取的合理措施有 (任写一种)。


图1 图2
(3) 在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为 。
② a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: ;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是 。
高纯度的绿矾(FeSO4·7H2O)是治疗缺铁性贫血的特效药。下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法: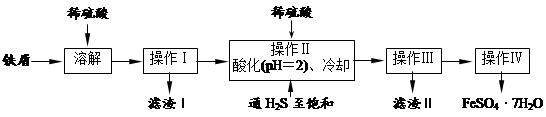
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是___________________________。
(2)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是_______________________;
通入硫化氢至饱和的目的是:①除去操作I所得溶液中含有的Sn2+等杂质离子;
②除去Fe3+,反应的离子方程式为___________________________。
(3)操作IV的顺序依次为:___________、降温结晶。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②____________________________。
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol·L—1 KMnO4溶液滴定至终点,反应为:
5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O
消耗KMnO4溶液体积的平均值为20.00mL。
计算上述样品中FeSO4·7H2O的质量分数为______________________。