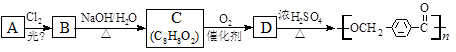
苯佐卡因是一种医用麻醉药品,学名对氨基苯甲酸乙酯。用芳香烃A为原料合成苯佐卡因E的路线如下: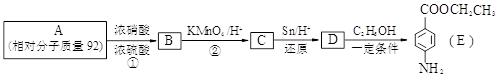
请回答:
(1)写出结构简式 B ________________ C _________________。
(2)写出反应类型 ① _______________ ② ________________。
(3)化合物D经聚合反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。写出该聚合反应的化学方程式:____________________________________________________________。
(4)下列化合物中能与E发生化学反应的是_________。
a.HCl b.NaCl c.Na2CO3 d.NaOH
(5)除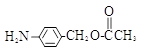 、
、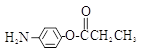 、
、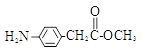 外,符合下列条件的化合物E的同分异构体有_____种。
外,符合下列条件的化合物E的同分异构体有_____种。
i. 为1,4—二取代苯,其中苯环上的一个取代基是氨基;ii. 分子中含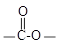 结构的基团
结构的基团
有氰化物的废水危害极大,能毒杀各种鱼类和水生物。CN-浓度在0.01—0.04 mg·L-1时就有强烈的毒杀作用,处理含有氰化物的工业废水的方法之一是:使CN-被氧化转变为低毒的CNO-(其毒性仅为氰化物的千分之一),一般转化为氰酸盐(如NaCNO)。氧化剂常用次氯酸盐,同时还可降解产生无毒气体。近期研究表明,在光的作用下,在某些悬浮小粒表面和溶液界面可发生明显的氧化还原反应,很快降解毒性,如在二氧化钛(TiO2)表面上可以降解氰化物等有毒物。
(1)二氧化钛在上述反应中的作用是______________________________________________。
(2)如果用NaClO处理含NaCl的废液,则可能生成另外两种盐(毒性降解),试写出此反应的化学方程式:_____________________________________________。(其中N均为-3价)
此反应中被氧化的元素是___________________________。
(3)氰酸盐再与次氯酸盐作用降解产生的无毒气体有哪些?
______________________________________________________________________________。
写出可能发生的离子方程式______________________________________________________。
炎热的夏天暴雨之前,空气中水蒸气含量大,气压低,鱼因缺氧出现翻塘死鱼现象,若不及时人工增氧会使鱼大量死亡,造成经济损失,请说明鱼塘翻塘缺氧的原因。
格氏试剂在有机合成方面用途广泛,可用于卤代烃和镁在醚类溶剂中反应制得。设R为烃基,已知:
R—X + Mg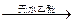 R—MgX(格氏试剂)
R—MgX(格氏试剂)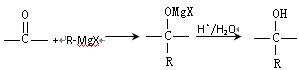
阅读如下有机合成路线图,回答有关问题: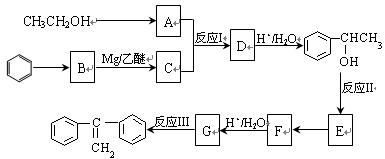
(1)在上述合成路线图中,反应I的类型是 ,反应II的条件是 。
(2)反应III的化学方程式为 。
(3)有机物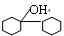 是合成药物中的一种原料,实验室可以用环己烯按以下合成路线合成该有机物:
是合成药物中的一种原料,实验室可以用环己烯按以下合成路线合成该有机物: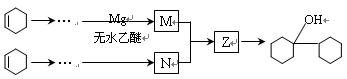
通过化学反应从环己烯到N可以通过多种途径实现,其中步骤最少可以通过 步完成,分别通过 (填反应类型)等反应实现。
其中N和Z的结构简式为:N ;Z 。
以下是某课题组设计的合成聚酯类高分子材料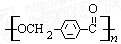 的路线:
的路线:
 已知:
已知: ①A的相对分子质量小于110,其中碳的质量分数约为0.9。
①A的相对分子质量小于110,其中碳的质量分数约为0.9。 ②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮: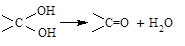
③C可发生银镜反应。 请根据以上信息回答下列问题:
请根据以上信息回答下列问题: (1)A的化学式为 ;A→B的反应类型是 。
(1)A的化学式为 ;A→B的反应类型是 。 (2)由B生成C的化学方程式为 ;
(2)由B生成C的化学方程式为 ;
该反应过程中生成的不稳定中间体的结构简式应是 。 (3)D的结构简式为 ,D的同分异构体中含有苯环且水解产物之一为乙酸的有______种,写出其中的一种结构简式: 。
(3)D的结构简式为 ,D的同分异构体中含有苯环且水解产物之一为乙酸的有______种,写出其中的一种结构简式: 。
(8分)某浅绿色溶液A中加入用硝酸酸化的硝酸银酸性溶液,生成白色沉淀B和黄色溶液C,再向溶液C中加入足量的氨水生成红褐色沉淀D。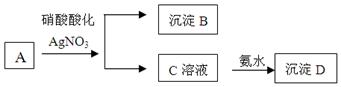
根据以上判断:
(1)A、B、C、D的化学式:A B C D
(2)写出C到D反应的离子方程式
(3)写出A和硝酸反应的化学方程式
不对称烯烃与HX发生加成反应时HX中的H原子加成到含H较多的碳原子上。俄国化学家马科尼可夫因提出不对称烯烃的加成规则而著称于世。
又知:①CH3CH2Br+NaCN CH3CH2CN+NaBr
CH3CH2CN+NaBr
②CH3CH2CN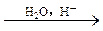
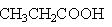
③CH3CH2COOH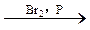 CH3CHBrCOOH
CH3CHBrCOOH
有下列有机物之间的相互转化:
回答下列问题:
(1)B→C的反应类型为 ;
(2)C→D、E→F的化学方程式为:
C→D ,
E→F(F为高分子时) 。
(3)F可以有多种结构,写出下列情况下F的结构简式:
①分子式为C7H12O5 ,②分子内含有一个七元环 。
2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1= -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2= -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3= -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:  (3)某实验小组依据甲醇燃烧的反应原理,
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如右图所示的电池装置。该电池正极的电极反应为
。
② 工作一段时间后,测得溶液的pH减小,
该电池总反应的化学方程式为
。
(2)一瓶无色气体,可能含有CH4和CH2==CH2,或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确,为什么?
。
②上述实验可能涉及的反应类型有 。
(3)含有 的化合物与CH2==CH2一样,在一定条件下可聚合成高分子化合物。
的化合物与CH2==CH2一样,在一定条件下可聚合成高分子化合物。
①广泛用作农用薄膜的聚氯乙烯塑料,是由 聚合而成的,其化学方程式是
聚合而成的,其化学方程式是
。
②电器包装中大量使用的泡沫塑料的主要成份是聚苯乙烯 ,它是由 (写结构简式)聚合而成。
,它是由 (写结构简式)聚合而成。
已知G的分子结构模型如右图所示(图中球与球之间连线表示单键或双键),用芳香烃A为原料合成G的路线如下:
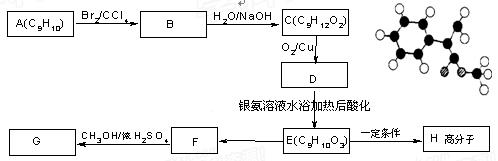
试回答下列问题:
(1)G的结构简式为 ,G的一种同分异构体的结构简式为 。
(2)化合物E中的含氧官能团有 (填名称)。
(3)A→B的反应类型是 ,E→F的反应类型是 。
(4)书写 化学方程式
化学方程式
C→D
E→H
SO2是引起大气污染的主要有害气体之一,我国大气质量标准中规定大气中SO2的最高浓度限值如下表:大气中SO2三级标准浓度限值
| |
浓度限值[mg/(m3空气)] |
||
| 一级标准 |
二级标准 |
三级标准 |
|
| 年日平均 |
0.02 |
0.06 |
0.10 |
| 日平均 |
0.05 |
0.15 |
0.25 |
| 任何一次 |
0.15 |
0.50 |
0.70 |
注:“年日平均”为任何一年的平均浓度均值不许超过的限值;“日平均”为任何一日的平均浓度不许超过的限值;“任何一次”为任何一次采样测定不许超过的浓度限值。据报道,1952年2月,某城市雾大无风,家庭和工厂排出的烟雾经久不散,大气中SO2的含量高达3.8mg/(m3空气),烟尘达4.5mg/(m3空气),居民健康普遍受到危害,4天之内死亡人数约4000,流经该城市的主要河道也因此而受到污染,引起鱼类死亡。大气中的SO2将直接危害陆生高等植物的____组织,大气中SO2超标最容易影响人的_______系统而患疾病,而河流中鱼类死亡与SO2造成大气污染所形成______有关。
某空气污染监测仪是根据SO2和Br2水的定量反应来测定空气中的SO2含量的。反应的溴来自一个装有酸性(稀硫酸)的KBr溶液的电解池阳极的氧化反应,电解池的阳极室与阴极室是隔开的。当测量某地区空气中SO2的含量时,一天中作了三次取样监测,每次取样的空气(已除尘)都以1.5×10-4m3.min-1的流速进入电解池的阳极室,从电流计显示出每次的电流强度分别为8.56×10-6A、9.25×10-6A 、8.12×10-6A,每次都能够保持电解池中Br2浓度恒定并恰好与二氧化硫完全反应(设空气中不含与溴反应的其它杂质、1个电子电量为1.6×10-19C)。
写出此监测过程中发生反应的化学方程式。计算该地区空气中二氧化硫的含量有没有达到大气质量标准?当大气中SO2污染较严重时,目前有一种降低其危害的方法是用直升飞机喷撒白垩粉,其化学方程式为___________________。
某火力发电厂所在地有较丰富的碳酸钙矿和菱镁矿,若该发电厂以含硫重油作燃料,请就地取材提出三种化学反应原理与上一小题不同的“脱硫”方法(用化学方程式表示,):
第一种______________;第二种______________;第三种______________。某10 6 kW火力发电厂以重油为燃料。以含硫3.5%的重油为燃料,重油使用量为0.18 dm3.kW-1.h-1(重油的密度为0.95g.cm3)。该厂开工率(每年实际运转天数)为80%,对烟道气的脱硫效率为90%。问一年间对烟道气脱硫回收的SO2能生成多少吨石膏(CaSO4·2H2O)?
铅是一种重金属,相对原子量为207。铅和铅的化合物有很多用途,如蓄电池等,但铅类化合物大多有毒,燃煤厂、金属冶炼厂等都有主要的铅污染源。铅一旦进入人体会累积,对人脑、肾脏和造血功能有损害。为了了解环境中的铅污染问题,小红他同学进行了如下的研究。
1.在走访调查中,小红观察到某乡镇颜料厂排出的废水带有颜色,经鉴定含有铅。为了测定废水中铅的浓度,他设计了如下实验步骤
(1)步骤中过滤需要的玻璃仪器是、和玻璃棒。
(2)步骤中操作称为,缺少此操作,测得结果(填"偏高"、"偏低"、或"无影响")。
2.通过研究,小红提出了一系列降低铅对环境污染的建议,下列建议中不恰当的是
| A. | 使用无铅汽油 |
| B. | 开发新的无铅燃料 |
| C. | 倡导使用铅蓄电池作动力的电动车 |
| D. | 燃煤电厂、金属冶炼厂的废气经除尘后排放。 |
现有CaCO3和KHCO3的混合物,甲、乙、丙三同学分别称取一定质量的该混合物来测定其中两成分的质量比,已知K2CO3的分解温度远大于1000 ℃;气体体积均已折算成标准状况: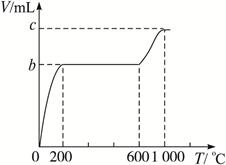
(1)甲同学称取2.00 g混合物,用滴定管向其中缓慢滴加2.00 mol·L-1的盐酸,当滴加到12.5 mL盐酸时不再产生气体,据此甲同学_________(填“能”或“不能”)计算出混合物两成分的质量比,若能,则m(CaCO3)∶(KHCO3)=________;若不能,此空不必做答。
(2)乙同学也取2.00 g混合物,并向其中加入过量的2.00 mol·L-1的盐酸,生成气体a mL。则a=________(填数字),据此乙同学________(填“能”或“不能”)计算出混合物两成分的质量比。若能,则m(CaCO3)∶m(KHCO3)=_________;若不能,此空不必做答。