下图是合成某种聚酯纤维H的流程图: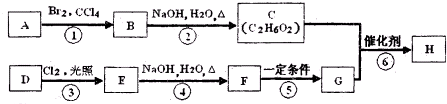
己知:A、D为烃,质谱图表明G的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧:G能与NaHC03溶液反应且含有苯环;核磁共振氢谱表明E、G分子中均有两种类型的氢原子,且E分子中两种类型的氢原子的个数比为1:1.
(1)①、⑤的反应类型依次为________________、__________________;
(2)B的名称为__________________,F的结构简式为__________________;
(3)写出下列化学方程式:
②__________________;
③__________________;
⑥__________________;
(4)F有多种同分异构体,写出同时符合下列条件的任意一种同分异构体的结构简式__________________;
a.含有苯环且苯环上只有2个取代基
b.能与NaOH溶液反应
c.在Cu催化下与O2反应的产物能发生银镜反应
6-羰基庚酸是一种重要的化工中间体,其合成路线如图:
已知: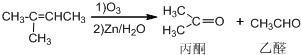
(1)反应①的试剂与条件是____________________;
(2)下列说法中正确的是_______________;
a.C能被催化氧化成酮
b.D不能使酸性高锰酸钾溶液褪色
c.Ni催化下1mol E最多可与2molH2加成
d.G既能发生取代反应,又能发生加成反应
(3)E与新制Cu(OH)2反应的化学方程式为____________________;
(4)G的同分异构体有多种,满足以下条件的同分异构体有__________种。
a.分子中含有环己烷的结构
b.能与NaHCO3溶液反应,放出气体
c.1mol该物质能与2molNa完全反应
(5)已知“Diels-Alder反应”为: 物质D与呋喃(
物质D与呋喃(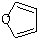 )也可以发生“Diels-Alder反应”,该化学反应方程式为____________________。
)也可以发生“Diels-Alder反应”,该化学反应方程式为____________________。
(1)某课外活动小组同学用图1装置进行实验,试回答下列问题:


图1 图2
①若开始时开关K与a连接,则铁发生电化学腐蚀中的___________腐蚀。请写出正极反应式: 。
②若开始时开关K与b连接时,两极均有气体产生,则N端是电源的__________极(填正或负)则总反应的离子方程式为______________________
(2)该小组同学设想,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠。
①制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)___________导出。通过阴离子交换膜的离子数________ (填“>”、“<”或“=”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因:_________________________
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下图进行反应。又知E溶液是无色的,请回答:
(1)A是________、C是________(请填化学式)。
(2)反应①的化学方程式为:______________________________。
(3)反应④的化学方程式为:______________________________。
(4)实验室制备气体B的化学方程式为:_____________________。
工业上铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如下图:
(1)步骤①反应的离子方程式是_____________、_______;
(2)滤液1中要加入稍过量原料B,原料B的化学式是_______________;步骤①②③均需进行的实验操作是__________(填操作名称)。
(3)步骤③中生成沉淀的化学方程式是_______________;
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响?_______________;
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为___________;
(2)A中的碳原子是否都处于同一平面?____________(填“是”或者“不是”);
(3)在图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
反应②的化学方程式为_____________;
C的系统命名名称是_____________;
E2的结构简式是_____________;
④、⑥的反应类型依次是______________、___________;
已知化合物A、D、E、G焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以冶疗胃酸过多。A~H各物质的变化关系如下图所示。

(1)写出各步反应的化学方程式
反应①
反应②
反应③
反应④
反应⑤
(2)上述反应中属于氧化还原反应的有 。
已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
| 元素 |
结构或性质信息 |
| X |
原子的L层上s电子数等于p电子数。 |
| Y |
原子核外的L层有3个未成对电子。 |
| Z |
在元素周期表的各元素中电负性仅小于氟。 |
| Q |
单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
| R |
核电荷数是Y与Q的核电荷数之和 |
| E |
原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有 种不同运动状态的电子,有 种不同能级的电子。
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) 。
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式) 。
(4)R的最高化合价为 。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心离子为(写化学式) ,配位体为(写化学式) ,x 的值为 。
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为 。
A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液。

请回答问题。
(1)物质A的化学式是 。
(2)检验E溶液中的金属离子,常选用的试剂是 (填化学式)。
(3)溶液B与气体F反应的离子方程式是 。
(4)物质C转化为物质D的反应中伴随的主要现象是 ,化学方程式是 。
(5)将SO2气体通入BaCl2溶液中无沉淀产生,再将此溶液一分为二,向其中一份中通入足量的氨气,有白色沉淀产生,该沉淀是 (填化学式)。向另一份中滴加几滴E溶液也有白色沉淀产生,请用离子方程式表示该沉淀的产生过程 。
 从铝土矿(主要成分是
从铝土矿(主要成分是 ,含
,含 、
、 等杂质)中提取
等杂质)中提取 的两种方法如下:
的两种方法如下:


 请回答下列问题:
请回答下列问题:
 (1)方法甲中,固体A的化学式____________
(1)方法甲中,固体A的化学式____________
 (2)方法乙加入烧碱后生成SiO32-的离子方程式为___________________
(2)方法乙加入烧碱后生成SiO32-的离子方程式为___________________
 (3)简述检验滤液B中含
(3)简述检验滤液B中含 的方法______________________________
的方法______________________________
 (4)滤液K中溶质的主要成份是 (填化学式),写出该物质的一种用途 。
(4)滤液K中溶质的主要成份是 (填化学式),写出该物质的一种用途 。
Ⅰ.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
a.取少量溶液,加入KSCN溶液,无明显变化
b.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
c.向b中所得溶液中加入BaCl2溶液,有白色沉淀生成
d.向b中所得溶液中加入过量浓氨水,仅有红褪色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
(已知Cu2+与过量浓氨水反应生成四氨合铜离子)请回答下列问题:
(1)该废水一定含有的离子是_____________;
(2)实验b中加入盐酸生成无色气体的离子方程式是________________;
(3)过滤除去d中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH- AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝___g。
AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝___g。
Ⅱ.某混合液中,可能大量含有的离子如下表:
| 阳离子 |
H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 |
Cl-、Br-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示:
(1)该溶液中一定含有的阳离子是_____________,溶液中一定不存在的阴离子是________。
(2)请写出沉淀减少的离子方程式________________________。
化合物A的分子式为C9H15OCl,分子中含有一个六元环和一个甲基,环上只有一个取代基;F分子中不含甲基:A与其它物质之间的转化如下图所示:

(1) A-F的反应类型是________________;G中含氧官能团的名称是____________。
(2)A-C的反应方程式是____________________。
(3)H的结构简式是____________________,E的结构简式是____________。
(4)有的同学认为B中可能没有氯原子,你的观点是________________(填“同意”或“不同意”)你的理由_______________。
(5)某烃的含氧衍生物X符合下列条件的同分异构体中,核磁共振氢谱显示为2组峰的是_____________(写结构简式);只含有两个甲基的同分异构体有____________种。
①相对分子质量比C少54 ;②氧原子数与C相同 ; ③能发生水解反应。
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H20(g),可以得到Fe304,写出其转化的化学方程式: 。
(2)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾的化学方程式 并配平:

(3)为测定溶液Ⅰ中铁元素的总含量,实验操作:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H202,调节pH<3,加热除去过量H202;加入过量KI充分反应后,再用 O.1OOOmol.L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-=2Fe2++I2 I2+2S2O32-=2I-+S4O62-
①写出滴定选用的指示剂 ,滴定终点观察到的现象 。
②溶液Ⅰ中铁元素的总含量为 g.L-1。若滴定前溶液中H202没有除尽,所测定的铁元素的含量将会 (填“偏高”“偏低”“不变”)。
(4)将3.48gFe3O4完全溶解在100mL 1 mol·L-1H2SO4溶液中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部反应,Cr2O72-转化为Cr3+。则K2Cr2O7溶液的物质的量浓度为
Ⅰ、A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3两种化合物。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
①D元素在元素周期表中的位置是______________。
②A与D所形成的化合物的电子式为___________________。
③将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的化学方程式为_______________ 。
Ⅱ、由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。

(1)若A为金属钠, A与水反应的离子方程式为 。
(2)若A为过氧化钠, A与水反应的化学方程式为 。
(3)A不论是Na还是Na2O2,依据转化关系判断物质D是 ,
(4)向30ml某浓度的B溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况(不计CO2的溶解),则曲线B表明M中的溶质为 ;原NaOH溶液的物质的量浓度为 ;由曲线A、B可知,两次实验通入的CO2的体积比为 。

(5)请你设计一实验证明Na2CO3溶液碱性比NaHCO3溶液的碱性强:__________________。
有机物A是一种纯净的无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A物质 18.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为_______。 |
(2)A的核磁共振氢谱如图: |
(2)A中含有________种氢原子。 |
| (3)另取A 18.0 g与足量的NaHCO3粉末反应,生成0.2 mol CO2,若与足量钠反应则生成0.2 mol H2。 |
(3)写出一个A分子中所含官能团的名称和数量_____________。 |
| (4)将此18.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者依次增重10.8 g和26.4 g。 |
(4)A的分子式为________。 |
| (5)综上所述A的结构简式_____________________________。 |