通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成。如图是用燃烧的方法确定有机物分子式的常用装置。
试回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是_____________ 。
(2)C装置中浓硫酸的作用是_______________。
(3)燃烧管中CuO的作用是_______________。
(4)若准确称取0.48 g样品,经充分燃烧,A管质量增加1.32 g,B管质量增加1.0 8 g,则该有机物是否含氧元素 ? ______填(有、无)该有机物的分子式为_______
8 g,则该有机物是否含氧元素 ? ______填(有、无)该有机物的分子式为_______
Ⅰ.现有四种化学仪器:
| A.量筒 | B.容量瓶 | C.滴定管 | D.烧杯 |
(1)标有“0”刻度的化学仪器为 ;(填代号,下同)
(2)实验时,要用所装液体润洗的是 ;
(3)使用前要检验是否漏水的仪器是 ;
(4)量取液体体积时,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x<n<y,则所用的仪器为 。
Ⅱ.向四支试管中分别加入少量不同的无色溶液进行如下操作:
| |
操作 |
现象 |
结论 |
| A |
滴加BaCl2溶液 |
生成白色沉淀 |
原溶液中有SO42- |
| B |
滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+,无K+ |
| D |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
请判断以上结论是否正确,并对不正确的说明理由:
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ; (2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的? (填“能”或“否”),理由是 。
(二)该小组中某同学设计了如下图所示的实验装置(部分夹持及尾气处理装置未画出),探究氨气的还原性:
(3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(4)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式 。
。
(三)问题讨论
(5)有同学认为:NH3与CuO反应生成的红色物质可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+ 的稳定性比Cu2+ 差(Cu+ Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O 。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O 。
(6)解决了问题(5)后,有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却 后称量,A的质量为72 g。据此可推得,A的化学式为 。由此,得到的结论是__________________
后称量,A的质量为72 g。据此可推得,A的化学式为 。由此,得到的结论是__________________ ______________。
______________。
(20分)A、B、C、D、E、F、G、H、I、J均为有机化合物。根据以下框图,回答问题: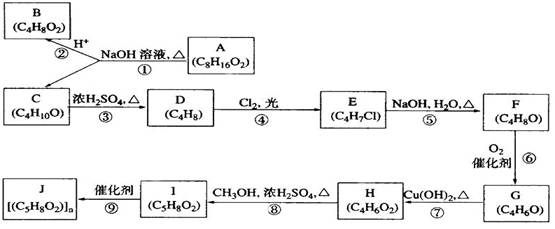 ( l ) B和C均为有支链的有机化合物,B 的结构简式______________________;C在浓硫酸作用下加热反应只能生成一种烯烃D , D的结构简式为:__________________;I的结构简式:______________________。
( l ) B和C均为有支链的有机化合物,B 的结构简式______________________;C在浓硫酸作用下加热反应只能生成一种烯烃D , D的结构简式为:__________________;I的结构简式:______________________。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为____;
(3)⑤的化学方程式是_____________________________________________;
⑨的化学方程式是______________________________________________;
(4)③的反应类型是______,④的反应类型是_____,⑦的反应类型是________;
(5)与H具有相同官能团的H的同分异构体的结构简式为______________。
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均 不带结晶水)
不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为 ;
在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为 、 、 。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
(1)各装置连接顺序为 → → 。
(2)能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。

(1)装置C中碱石灰的作用是 ,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为 。
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L硫酸溶液,其他试剂任选。填写下列空白: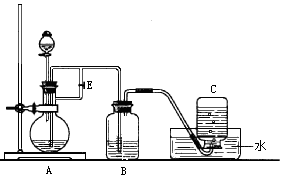
(1)B中盛有一定量的NaOH溶液,D仪器的名称 ,此实验D仪器中需要
放入 溶液,A中应预先加入的试剂是 ,A中反应的离子方程式
为 。
(2)实验开始时应先将活塞E (填“打开”或“关闭”), 在C中收到的气体主要为 ;当C瓶或A瓶中的气泡 时,将活塞E (填“打开”
或“关闭”),此刻B瓶中可能发生的化学反应(用离子方程式表示)是:
_ ;
(3)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:
。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。请回答:
(1) 装置A中发生的化学反应方程式为 。(2) 装置D中试管口放置的棉花中应浸一种液体,这种液体是  ,
,
其作用是 。
(3) 装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 。_B中应放置的液体是(填字母) 。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4) 实验中,取一定质量的铜片和一定体积18 mol·L—1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
① 有一定量的余酸但未能使铜片完全溶解,你认为原因是
。
② 下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.NaHCO3溶液
如图所示的仪器装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯。反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验乙酸乙酯和水层:第一种方法加入几滴KMnO4溶液,结果两层都没有颜色,无法区别;第二种方法是加入少量碘片,结果是上层液体呈紫红色。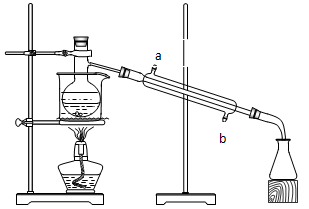
在这个实验中:(1)水浴的作用是 ,浓硫酸的作用是 。
(2)水流经冷凝管时,应从 口进入。(填a或b)
(3)烧杯中乙酸乙酯在 层,根据是 ,加入几滴KMnO4溶液后,水层不显紫色,是因为 。
(4)粗制乙酸乙酯经过提纯,可得到纯净的酯,提纯的操作方法是 。
工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂
亚氯酸钠(NaClO2),其工艺流程如下: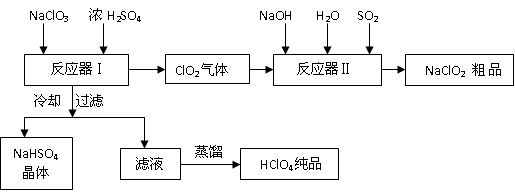
已知:
1.NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
2.高氯酸是至今为止人们已知酸中的最强酸,沸点90℃。
请回答下列问题
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用另一物质H2O2代替同样能生成 NaClO2 ,请简要说明双氧水在反应中能代替SO2的原因是
(4)Ca(ClO)2 、ClO2、NaClO、NaClO2 等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有 请写出工业上用氯气和NaOH溶液生产另一种消毒剂 NaClO的离子方程式
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
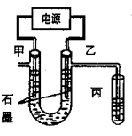
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为_________________。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测,甲电极附近溶液的pH=a,此时甲电极附近c(Cu2+)="________" mol·L-1。(已知:Cu(OH)2的Ksp=2.2*10-20)。
某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 |
现象 |
结论及解释 |
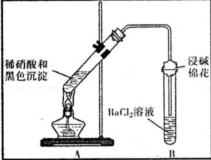 |
①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 |
a.现象②说明褐色沉淀具有 性. b.试管B中产生白色沉淀的总反应的离子方程式为 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2溶液反应完全.则混合物中Cu2S 的质量分数为 .
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图(夹持仪器略):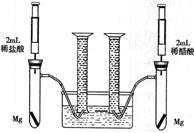
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为____________________。
(2)在上述实验方案中有一明显欠缺,该欠缺是____________。
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是____________;最终产生氢气体积的关系应是_______________。
(4)实验中产生的氢气体积比理论值高,可能原因是_______________________。
(5)通过比较起始反应的速率可以得出的结论是______________。
(6)除上述方法外,还可以通过其他方向比较盐酸和醋酸的酸性,请写出其中的一种方法_________。
某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm |
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____________________________ ______;
(2)操作中锥形瓶下垫一张白纸的作用是___________________________________________;
(3)判断到达滴定终点的实验现象是_________________________________ ____;
(共6分)实验室制取SO2的反应原理之一为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:( ×100℅)
×100℅)
(1)这些装置的连接顺序(按气体左右的方向)是 → → → → → → → → (填各接口的编号)。
(2)实验时甲橡胶管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
(9分)8.34gFeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。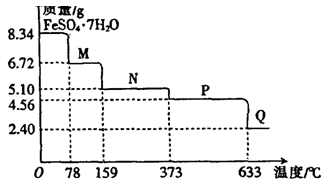
请回答下列问题:
(1)试确定78℃时固体物质M的化学式: 。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,写出该反应的化学方程式 。
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。
①试剂X的名称是 。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→ 。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量 (填计算式) 。