(6分)如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的相接处吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入CuSO4溶液。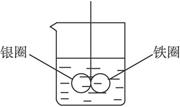
(1)片刻后可观察到的现象是_________ (指悬吊的金属圈)。
| A.铁圈和银圈左右摇摆不定 |
| B.保持平衡状态不变 |
| C.铁圈向下倾斜 |
| D.银圈向下倾斜 |
(2)产生上述现象的原因是_________。
中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题: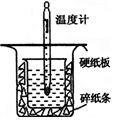
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是 。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于___________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进
行反应与上述实验相比,所放出的热量 (填“相等”“不相等”),若实验操作均正确,则所求中和热 填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(11分)铜及其化合物一般都具有特征颜色,例如Cu、Cu2O呈红色,CuO呈黑色、CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室用H2还原CuO所得的红色固体中是否含有 Cu2O进行了认真探究。
Ⅰ.查阅资料:Cu2O属于碱性氧化物;高温灼烧CuO生成Cu2O;Cu2O在酸性条件下能发生下列反应:
Cu2O+2H+===Cu+Cu2++H2O
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色的变化。
方案2:取该红色试样溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a g,取红色试样置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
(1)请你评价方案1和方案2。如果你认为该方案合理,请简述其化学原理;如果你认为该方案不合理,请简述原因。
方案1:____________________________________________________________。
方案2:__________________________________________________________。
(2)方案3中,若确认红色粉末中含有Cu2O,则a、b、c应符合的数学的关系为________,该实验方案最少得进行________次称量。
Ⅲ.研究性学习小组乙,设计了新的探究方案,拟通过干燥管中CuSO4是否变蓝判断红色固体中是否含有Cu2O,装置如图所示:
(3)简述该探究方案中,检验气体发生装置气密性的方法(说明操作方法、现象和结论)
________________________________________________________________________。
(4)为确保探究的科学、合理、安全,你认为实验中还应采取的措施有________(填序号)。
A.在氢气发生器与硬质玻璃管之间加一干燥装置
B.加热前先排尽装置中的空气
C.在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
某研究性学习小组为确定某纯净碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分)。[已知碱式碳酸镁Mgx(OH)y(CO3)z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]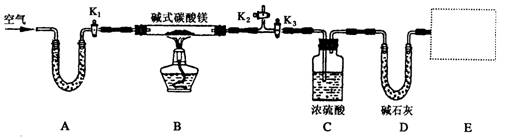
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是__________;A处U形管盛放的药品是__________________,其作用为_______________________。
(2)指导老师在审阅设计方案后指出需要在E处增加一装置,你认为该装置应该是_____________________________.
(3)加热前需要向该装置缓缓鼓入空气数分钟,其目的是___________________;此时对活塞的操作方法是:打开活塞____________________,关闭活塞_________________。
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,这是由于_________________________。
(5)反应完全后,打开K1,再缓缓鼓入空气数分钟,其目的是_____________________。
(6)实验测得数据如下:碱式碳酸镁样品22.6 g;反应前C装置的质量为87.6 g,反应后质量为89.4 g;反应前D装置的质量为74.7 g,反应后质量为83.5 g。请计算推导该碱式碳酸镁的化学式______________________,该碱式碳酸镁受热分解的化学方程式为____________。
为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是 ;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是 (用操作编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为_____________;
(4)当D中产生__________(多选不得分)现象时,可以说明使E中澄清石灰水变浑的是CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
则装置D的作用为 。
某化学实验小组,通过Li3N固体水解生成氢氧化锂和氨气的反应制氨气,并进行氨气还原氧化铜的实验探究。如下图所示,给出了本实验可供选择的装置:
请回答下列问题:
(1)按该方法制氨气时,应选用上述装置中的 (填装置代码,下同)做氨气发生装置。
(2)为检验氨气还原氧化铜反应后生成Cu、H2O、N2,氨气发生装置后应依次连接 → C → → →
(3)在C装置前后连接的装置中,填充的药品按前后顺序分别为 、 。
(4)有资料提出:CuO被还原时,当黑色固体完全变为红时,不一定完全转化为Cu,可能还含有Cu2O。已知查阅到一离子反应方程式:Cu2O+2H+=Cu2++Cu+H2O。依据该信息,若证明C处的红色固体中是否含有Cu2O ,请设计实验: 。
(5)实验时充分加热,至C装置质量不再减轻为止。实验完毕后,若实验测得收集的N2体积为aL(已折算为标准状况)。则若用CH4还原同样多CuO,理论上最少需要CH4的体积为(标准状况,用含字母a的代数式表示) L。
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
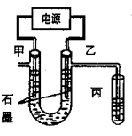
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为_________________。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测,甲电极附近溶液的pH=a,此时甲电极附近c(Cu2+)="________" mol·L-1。(已知:Cu(OH)2的Ksp=2.2*10-20)。
某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 |
现象 |
结论及解释 |
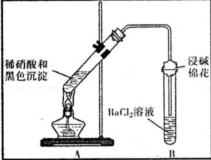 |
①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 |
a.现象②说明褐色沉淀具有 性. b.试管B中产生白色沉淀的总反应的离子方程式为 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2溶液反应完全.则混合物中Cu2S 的质量分数为 .
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图(夹持仪器略):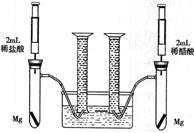
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为____________________。
(2)在上述实验方案中有一明显欠缺,该欠缺是____________。
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是____________;最终产生氢气体积的关系应是_______________。
(4)实验中产生的氢气体积比理论值高,可能原因是_______________________。
(5)通过比较起始反应的速率可以得出的结论是______________。
(6)除上述方法外,还可以通过其他方向比较盐酸和醋酸的酸性,请写出其中的一种方法_________。
某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm |
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____________________________ ______;
(2)操作中锥形瓶下垫一张白纸的作用是___________________________________________;
(3)判断到达滴定终点的实验现象是_________________________________ ____;
(共6分)实验室制取SO2的反应原理之一为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:( ×100℅)
×100℅)
(1)这些装置的连接顺序(按气体左右的方向)是 → → → → → → → → (填各接口的编号)。
(2)实验时甲橡胶管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
(9分)8.34gFeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。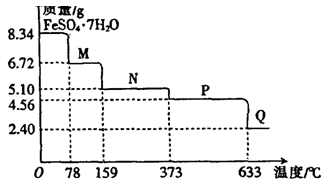
请回答下列问题:
(1)试确定78℃时固体物质M的化学式: 。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,写出该反应的化学方程式 。
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。
①试剂X的名称是 。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→ 。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量 (填计算式) 。
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)混合①中使用冰水的目的是 。
(3)操作Ⅱ和操作Ⅲ的名称分别是 、 。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为 。
某化学兴趣小组的同学,在学习了高中化学第三册中有关草酸的性质,查阅了大量资料,获得了草酸的一些信息,整理出下表:
| (1) 草酸晶体 |
分子式 |
H2C2O4·2H2O |
颜色 |
无色晶体 |
| 熔点 |
100.1℃ |
受热至100.1℃时失去结晶水,成为无水草酸。 |
||
| (2) 无水草酸 |
结构简式 |
HOOC—COOH |
溶解性 |
能溶于水或乙醇 |
| 特性 |
大约在157℃升华(175℃以上发生分解)。 |
|||
| 化学性质 |
H2C2O4 + Ba(OH)2 =BaC2O4↓+ 2H2O |
|||
| HOOC—COOH >175℃ CO2↑+CO↑+H2O↑ |
该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证无水草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物(FexOy),以确定FexOy的组成。
请回答下列问题:
(1)实验所需的仪器装置如上图所示,各装置的连接顺序为:
e接 、 接 、 接 、 接 h 。
(2)该组同学进行了下列实验操作:
①点燃B处的酒精灯;
②检查实验装置的气密性并装入药品;
③反应结束后,先熄灭B处的酒精灯,继续通入气体直到B中固体全部冷却后,再熄灭c处的酒精灯;
④点燃c处的酒精灯,开始反应,在装置E的i口处收集一试管气体,验纯;
⑤点燃尖嘴i处的酒精灯。
正确的实验操作顺序是: 。
(3)收集气体验纯的目的是 。
D装置中澄清石灰水的作用是 。
E装置中澄清石灰水的作用是 。
(4)反应完全后,该组同学进行数据处理。反应前,称得硬质玻璃管的质量为54.00 g,样品FexOy的质量为7.84 g;反应后,称得硬质玻璃管与剩余固体的总质量为59.60g(其质量经同样操作后也不再发生变化),则样品FexOy中,x:y= 。
(5)本实验有没有不妥之处?如果有,请答出改进的方案;若无,此问可不必答。
。