(6分)如图所示,在大试管里放入一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置约一周后,观察到铁丝发生的变化是______________________,原因是______________________。试管里的水面会上升,最终上升高约为___________,原因是____________________________________________。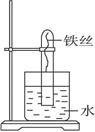
(6分)如图所示,在大试管里放入一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置约一周后,观察到铁丝发生的变化是______________________,原因是______________________。试管里的水面会上升,最终上升高约为___________,原因是____________________________________________。