某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)  2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
试求:(1)该温度下反应的平衡常数
(2)H2的起始浓度
(3)用N2表示该反应的平均反应速率
(4)N2的转化率
维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行测定。该反应的化学方程式如下:C6H8O6+I2 C6H6O6+2HI,现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10 mL 6 mol/L CH3COOH,加入100 mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中。加入1 mL淀粉指示剂,立即用浓度为0.05000 mol/L的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00 mL I2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)计算样品中维生素C的质量分数。
用MnO2,和浓HCl反应制Cl2,当有0.4molHCl被氧化时,生成的Cl2全部用石灰水吸收,则(1)生成多少Cl2mol(2)可制得漂白粉多少克?
向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
(2)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色团体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少
用KMnO4氧化密度为1.19g/cm3,溶质质量为36.5%的 HCl.反应方程式如下:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)15.8g KMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(2)若Cl 2在标准状况下的密度为3.17g/L,则产生的Cl 2在标准状况下的体积为多少?
(1)实验室常用的浓盐酸密度为1.17g/mL、质量分数为36.5%。此浓盐酸的物质的量浓度为 mol/L。取此浓盐酸43mL,用蒸馏水稀释至200mL,稀盐酸的物质的量浓度为 mol/L。
(2) 4.8g镁投入此200mL稀盐酸中,反应后,求:
①放出的H2在标准状况下的体积。
②将生成的H2通过过量的灼热CuO,求被还原出的铜的质量。
③反应后(设溶液体积不变)溶液中两种阳离子的物质的量浓度之比。
计算题
取1.43g Na2CO3·XH2O 溶于水配成10ml 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0ml,并收集到112ml CO2(标况)。
求(1)稀盐酸物质的量浓度(2)Na2CO3·xH2O的摩尔质量(3)x值
用KMnO4氧化密度为1.19g/cm3,溶质质量为36.5%的 HCl.反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)15.8g KMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(2)若Cl 2在标准状况下的密度为3.17g/L,则产生的Cl 2在标准状况下的体积为多少?
在某温度下,将H2和I2各0.10mol 的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得 c(H2)= 0.0060mol/L
(1)求该反应的平衡常数。
(2)在上述温度下,该容器中若通入H2和I2蒸汽各0.20mol 的气态混合物,试求达到化学平衡状态时各物质的浓度
一定量的铁与稀盐酸反应,生成了4.48L(STP)氢气。
(1)计算发生反应的氯化氢和铁的物质的量分别为多少?
(2)若所用盐酸的浓度为0.5 mol·L-1,则至少需要盐酸的体积为多少升?
将11.26克小苏打和纯碱晶体(Na2CO3• 10H2O)的混合物加热充分反应后,残留固体溶于水,配制成100克溶液,所得溶液中Na2 CO3的质量分数为6.36%,试求:
CO3的质量分数为6.36%,试求:
(1)原混合物中含小苏打及纯碱晶体的质量各是多少?
(2)若加热原混合物将失重多少克?
在标准状况下,将224L的HCl气体溶于635mL的水中(设水的密度为1.00g/cm3),求所得盐酸的质量分数。若取出这种盐酸(密度为1.19g/cm3)10.0mL稀释至1190mL,则稀释后盐酸的物质的量浓度为多少?
在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,下图表示加入的混合物的质量和产生气体的体积(标准状况)关系。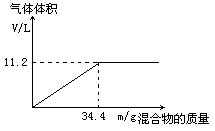
(1)试计算NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?