通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是 ;
(2)X与金属钠反应放出氢气,反应的化学方程式是 (有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y, Y在适当的条件下,可进一步被氧化生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184gX和120gZ反应能生成106gW,计算该反应的产率。(产率为实际产量与理论产量的比值)(要求写出计算过程)
(1).中和pH=3的醋酸(Ka=1.75×10-5)100mL,需要 0.1mol/LNaOH溶液的体积为:____________.
0.1mol/LNaOH溶液的体积为:____________.
(2).在一定体积0.005mol/LBa(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH = 11.假设反应后溶液的体积等于Ba(OH )2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是______________.
)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是______________.
实验室可用如下反应制取氯气,反应原理如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)用单线桥表示出上述反应中电子转移的方向和数目
(2)上述反应中氧化剂与还原剂的物质的量比
(3)15.8g KMnO4能使多少克HCl被氧化?
(4)产生的Cl2在标准状况下的体积为多少?(
由铜片、锌片和200mL稀硫酸组成的原电池中,当铜片上放出3.36L(标状况)气体时(锌片上无气体产生),硫酸恰好反应完.计算:
(1)产生这些气体消耗的金属是哪一种,消耗的质量是多少;
(2)有多少电子通过了导线;
(3)硫酸溶液的物质的量浓度是多少.
在标准状况下,将224L HCl气体溶于635mL水中,所得盐酸的密度为1.18g/cm3。
试计算:
(1) 所得盐酸的质量分数和物质的量浓度
所得盐酸的质量分数和物质的量浓度
(2)取出这种盐酸100mL,稀释至1.18L,所得稀盐酸的物质的量浓度。
(每小题2分,共6分)已知室温下KW = 1.0×10—14。
(1)计算室温条件下0.1mol/LHCl溶液中由水电离的氢离子浓度。
(2)计算室温条件下0.01mol/LNaOH溶液的PH。
(3)计算上述两种溶液完全中和至中性时,需要两溶液的体积比。
.将某温度下的KNO3溶液200g蒸发掉10g水恢复到原温度,或向其中加入10gKNO3固体均可使溶液达到饱和.试计算:
(1)该温度下KNO3的溶解度.
(2)原未饱和溶液中溶质的质量分数
.在一定条件下,NO跟NH3可以发生反应生成N2和H2O,现有NO和NH3的混合物1mol ,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g.
(1)写出反应的化学方程式,并标出电子转移的方向和数目.
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少?
在500mL 0.2 mol·L-1的稀硝酸中加入1.92克铜片,让其充分反应(反应生成硝酸铜、一氧化氮和水)。试求
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
(3)若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2 mol·L-1的氢氧化钠溶液多少毫升?
用a g氢气与b g氯气合成氯化氢气体,然后将反应后的气体用足量的氢氧化钠溶液充分吸收,试根据氢气、氯气体积比的不同情况讨论:
(1)吸收后剩余气体的质量。(2)吸收后生成食盐的质量。
已知: MnO2 +4HCl(浓) △ === MnCl2 + Cl2↑+ 2H2O。一定质量的二氧化锰溶解在100mL 过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变)。请计算:
⑴反应耗用MnO2的质量
⑵被氧化的HCl物质的量
(3)原浓盐酸的物质的量浓度
我们可以通过以下实验步骤来验证醋酸银(CH3COOAg)的溶度积KSP=2.0×10-3:将已知质量的铜片加入到CH3COOAg饱和溶液中(此饱和溶液中没有CH3COOAg固体),待充分反应之后,将铜片冲洗 干净、干燥、称重.
干净、干燥、称重.
(1)写出表示CH3COOAg沉淀溶解平衡的方程式.
(2)刚开始铜片的质量为23.4 g,将铜片放在100 mL的CH3COOAg饱和溶液中,通过 计算说明当充分反应
计算说明当充分反应 后铜片的质量为何值时,CH3COOAg的KSP=2.0×10-3可以得到证实.(
后铜片的质量为何值时,CH3COOAg的KSP=2.0×10-3可以得到证实.(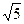 =2.24,
=2.24,  =1.41)
=1.41)
高炉炼铁是冶炼铁的主要方法。
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体 (填化学式),会污染空气。100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少。高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿) 。
(2)已知:①4Fe(s) + 3O2=2Fe2O3(s) ΔH1
②4Fe3O4(s)+O2(g)=6Fe2O3(s) ΔH2
③3Fe(s)+2O2(g)=Fe3O4(s) ΔH3
则ΔH2= (用含上述ΔH的代数式表示)。
(3)高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________。
(4)某温度下,HX的电离平衡常数K为1×10-5。计算该温度下0.100mol/L的HX溶液的 H+浓度。(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计,写出计算过程。)